学习小组同学用如图装置进行实验。打开分液漏斗的活塞,将NaOH浓溶液加入锥形瓶A中,关闭活塞,打开弹簧夹,观察到A中产生白色沉淀,烧杯B中液面降低。
(1)写出CO2与NaOH溶液发生反应的化学方程式: 。
(2)若X是一种碱,其化学式可能是 (只写一种)。
(3)学习小组同学用的X是CaCl2,实验结束后,同学们又分别做了以下三组实验:
①取少量A中溶液,测其pH,pH>7
②取少量A中溶液,向其中加入CaCl2溶液,无明显现象,再测其pH,pH>7
③取少量A中溶液,测其pH,pH>7,再向其中加入K2CO3溶液,产生白色沉淀
查阅资料可知CaCl2溶液呈中性。
以上三组实验事实中,能说明A中溶液一定含有NaOH的是 (填序号)。

学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )

A.①B.②C.③D.④
河道两旁有甲、乙两厂,它们排放的工业废水中共含H +、Na +、Ba 2+、Cl ﹣、SO 4 2 ﹣、CO 3 2 ﹣六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,则甲厂废水中的离子是( )
| A. |
H +、Na +、Ba 2+ |
B. |
H +、Ba 2+、Cl ﹣ |
| C. |
Na +、SO 4 2 ﹣、CO 3 2 ﹣ |
D. |
H +、SO 4 2 ﹣、CO 3 2 ﹣ |
下列有关推理正确的是( )
| A. |
过滤和蒸馏是常用的净水方法,均可以使硬水变为软水 |
| B. |
O 2和CO 2的组成中都含有氧元素,构成它们的微粒中都有氧分子 |
| C. |
混合物是由不同物质组成的,同一种元素不可能组成混合物 |
| D. |
pH>7的溶液呈碱性,则碱性溶液的pH一定大于7 |
厨房里有两瓶白色固体,分别为食盐(NaCl)和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是 。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是 。
方案二:加水溶解,分别滴加 溶液,有沉淀产生的是纯碱。
蓝莓中含有的花青素(化学式为 C 15H 11O 6)具有缓解眼睛疲劳、保护视力的作用。酸能使花青素溶液变成红色,碱能使花青素溶液变成蓝色。下列说法不正确的是( )
| A. |
花青素中氢元素的质量分数最小 |
| B. |
一个花青素分子中共有32个原子 |
| C. |
向pH=11的草木灰水中滴加花青素溶液,溶液变成红色 |
| D. |
花青素分子中碳、氢、氧原子个数比为 15:11:6 |
古往今来,金属材料和制品在生产生活中应用广泛。
(1)三星堆遗址发掘现场出土了华丽的鸟型金饰片,金能被加工成超薄金箔,是因为金具有良好的 ;同时出土的铜头像、青铜神树等表面有锈迹,铜生锈的主要原理是:2Cu+H2O+O2+X═Cu2(OH)2CO3,X的化学式为 。
(2)向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤得到滤渣和滤液。
①在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化,则滤液中一定没有的阳离子是 (填离子符号)。
②向滤渣中再滴入稀硫酸产生气泡,则滤渣中一定含有 (填名称)。
下列实验方案设计完全合理的是( )
A.除去NaCl中的少量KNO3,可先加水,并加热溶解,再降温结晶
B.除去KCl溶液中的少量K2SO4溶液,加过量BaCl2溶液,过滤
C.除去CO中的少量CO2气体,依次通过足量NaOH溶液、浓硫酸
D.鉴别硫酸铵和氯化铵,分别加熟石灰、研磨、闻气味
某无色混合溶液中大量存在四种离子,其个数比为Al3+:NO3﹣:SO42﹣:M=1:1:3:2,则M为( )
A.Cu2+B.Na+C.Cl﹣D.Mg2+
2021年“世界水日”的主题为“珍惜水、爱护水”。
(1)2021年5月10日,“南水北调东线北延应急供水工程”启动向天津等地供水,以缓解我市可利用淡水资源 的现状。
(2)下列有关保护水资源的说法正确的是 (填序号)。
A.生活污水可直接排放
B.工业上对污染的水体作处理使之符合排放标准后再排放
C.农药、化肥的施用会造成水体污染,应该禁止施用
(3)如图是利用海水提取粗盐的过程。

根据海水晒盐的原理,下列说法正确的是 (填序号)。
A.进入贮水池中的海水,氯化钠的质量逐渐减少
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.析出晶体后,母液中的氯化钠溶液达到饱和
(4)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为 g。
②配制过程有以下步骤:a.称量及量取b.计算c.溶解d.装瓶贴标签,正确顺序是
(填序号)。
A.bcad
B.bacd
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水 g。
(5)为研究水的组成,某同学进行了电解水实验。
①电解水的化学方程式为 ;
②电解水的实验证明水是由 元素组成的。
硫酸是一种常见的酸,完成下列问题。
(1)实验室浓硫酸稀释的方法是 。
(2)为研究稀硫酸的化学性质,某同学进行了如图实验。
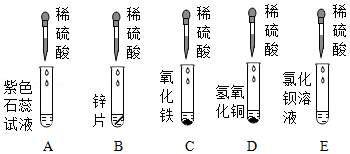
实验中,有气泡产生的反应的化学方程式是 ,溶液有颜色变化的是
(填序号),E试管中观察到的现象是 。
如图一所示为稀盐酸和氢氧化钠溶液反应的实验操作,图二为反应过程中烧杯内溶液pH的变化曲线。下列说法不正确的是( )
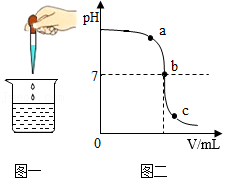
| A. |
胶头滴管中所取的溶液为氢氧化钠溶液 |
| B. |
b点表示溶液中氢氧化钠和盐酸恰好完全反应 |
| C. |
a点表示的溶液能使酚酞溶液变红 |
| D. |
c点表示的溶液中溶质是NaCl和HCl |
预防新型冠状病毒肺炎,常用84消毒液对环境进行消杀。常温下测得某84消毒液显碱性,其pH可能为( )
| A. |
12 |
B. |
5 |
C. |
7 |
D. |
2 |
NaHCO3在生产和生活中有许多重要用途,某学习小组对其性质进行了如下探究。物质的溶解度见下表。回答下列问题:
温度 |
10℃ |
20℃ |
NaHCO3的溶解度(g/100g水) |
8.1 |
9.6 |
Ca(HCO3)2的溶解度(g/100g水) |
16.6 |
(1)在20℃时称取4g NaHCO3加入46mL蒸馏水(密度取值为1g/mL),充分搅拌制得澄清溶液。该实验可以达到探究NaHCO3 性的目的;实验中不需要的仪器是 (选填字母编号)。

(2)用pH计测得溶液的pH为8.2,说明溶液呈 性。
(3)所配NaHCO3溶液的质量分数等于 ,降温到10℃时溶液 (填“是”或“不是”)饱和溶液。
(4)取2mL所配NaHCO3溶液于试管中,滴加5%的CaCl2溶液,观察到气泡和白色沉淀,实验证明该气体是CO2.据此小组同学讨论认为:白色沉淀不可能是Ca(OH)2,其理由是 ,于是得出结论:白色沉淀是 。
试题篮
()