按要求写出下列反应的符号表达式,并在括号内标明该反应的基本反应类型。
(1)某金属在氧气中燃烧,火星四射,生产黑色固体 ,( )反应;
(2)实验室用黑白两种固体混合加热制取氧气 ,( )反应;
(3)氢气在氯气中燃烧生成氯化氢 。
下列关于氧气(O2)的说法不科学的是
| A.常用带火星的木条来检验空气中的O2 |
| B.硫在O2里燃烧产生明亮的蓝紫色火焰 |
| C.工业上将空气液化后再进行分离来制取O2 |
| D.加热KClO3制O2,可用MnO2作催化剂 |
A~G是初中常见的7种物质,它们有如下图所示的转化关系。
已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰。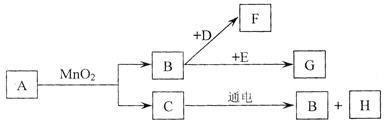
(1)请写出下列物质的化学符号:D___________,G___________,H___________。
(2)请写出下列变化的文字表达式:①B→F___________,②C→B___________。
过氧化氢溶液分解反应的催化剂很多。化学兴趣小组的同学设计如下四组实验,比较两种物质的催化效果,其中观察效果较差的是
 |
 |
 |
 |
| 第一组 |
第二组 |
第三组 |
第四组 |
A.第一组同时实验,观察比较反应过程中两个气球体积的变化
B.第二组同时实验,观察比较反应过程中两者产生气泡的快慢
C.第三组分两次实验,看木条是否能复燃
D.第四组分两次实验,比较收集一定体积的气体所需要的时间
A~E是初中常见的五种物质。常温下,A与B、C与D的状态相同;D具有助燃性和氧化性,E是暗紫色的固体。物质间的转化关系如右图(图中“—”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系。部分反应物、生成物及反应条件已略去)。请回答:
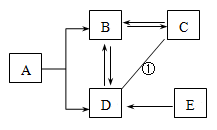
(1)写出物质E的化学式 。
(2)写出反应①的化学方程式 ,基本反应类型是 反应。
(3)试从微观解释A与B化学性质不同的原因是 。
实验小组用如图装置测定空气中的氧气含量,锥形瓶中空气的体积为100mL,注射器中水的体积为25 mL,装置气密性良好。下列说法不正确的是
| A.气球的作用是缓冲装置中的压强变化 |
| B.瓶底的细沙可以防止红磷燃烧时集气瓶炸裂 |
| C.红磷熄灭后应该等装置冷却到室温,再打开弹簧夹观察现象 |
| D.打开弹簧夹后,注射器中的水一定全部进入锥形瓶中 |
某同学在实验室用加热高锰酸钾的方法制取氧气,并采用排水法收集氧气.下列有关操作或看法错误的是
| A.先检查装置气密性,再装入药品 |
| B.加热高锰酸钾不会生成水,故试管管口不必略向下倾斜 |
| C.为了防止高锰酸钾加热时堵塞导气管,试管口要放一团棉花 |
| D.结束实验时,要先撤导气管出水面,再熄灭酒精灯 |
请根据下列实验装置图回答问题:

(1)写出仪器的名称:a是_ __;b是 。
(2)若用B装置制氧气,反应的文字表达式是 __________;
(3)甲烷是密度小于空气、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物制取甲烷。制取甲烷的发生装置应选择__________(填装置编号,下同),收集装置应选___________;
(4)右图是“空气中氧气体积分数测定”实验的改进装置。主要操作是:在实际容积为 150mL的集气瓶里,先装进50mL的水,再按图连好仪器,按下电加热棒,白磷立即被点燃。

①白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是_ ________;若实验非常成功,最终集气瓶中水的体积约为___________mL。
②集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?____________(填写序号)
a.加快集气瓶冷却 B.液封导气管末端以防气体逸出 C.缓冲集气瓶内气压的骤然升高
对资料或实验证据的分析是否正确,直接关系到科学探究是否符合客观事实。下图为实验室用等质量的高锰酸钾和氯酸钾(另加少量的二氧化锰),分别制取氧气的数据分析示意图。下列依据图示信息所得出的分析正确的是
| A.同时开始加热,先收集到氧气的是氯酸钾 |
| B.用相同容积的试管制取较多量的氧气时,宜选择氯酸钾为原料 |
| C.加入少量的二氧化锰使氯酸钾产生的氧气质量增加 |
| D.反应时间较长的是高锰酸钾 |
某种无色液体A和某种黑色粉末B混合后加热,生成无色液体C和无色气体D;另取一种黑色固体E,点燃后放入D中,发出白光,放出大量的热,只生成无色能使澄清石灰水变浑浊的气体F
(1)请分别写出A、C、D、F的化学式:
A 、C 、D 、F ;
(2)黑色物质B在反应中起 作用,写出该反应的方程式 ;
(3)写出E和D反应生成F的方程式 ;
a和b为质量相等的两份固体,a为氯酸钾与二氧化锰的混合物,b为氯酸钾,分别同时加热a和b至完全反应,下列图像能正确表示氧气的质量随时间变化关系的是
某同学发现一瓶没有塞上瓶塞的过氧化氢溶液。查资料得知,过氧化氢溶液在光线的直射下也能分解成氧气和水。他想探究这瓶过氧化氢溶液是否已经完全分解,与同学们一起进行如下实验。
【猜想与假设】
猜想Ⅰ:这瓶过氧化氢溶液已经完全分解。 猜想Ⅱ:这瓶过氧化氢溶液未完全分解。
【设计实验】为了验证猜想,甲、乙、丙三位同学分别提出如下方案:
甲同学:取适量试剂于试管中,伸入带火星的木条,若带火星的木条复燃,则猜想Ⅰ成立,若带火星的木条不复燃,则猜想Ⅱ成立。同学们认为此方案不行,原因是_______________________。
乙同学:取等量的过氧化氢溶液于A、B两个试管中,向A试管中加入少量二氧化锰,再把带火星的木条分别伸入A、B试管中,若观察到_____________________,则猜想Ⅰ成立。该实验中,B试管的作用是_____________。
丙同学:
| 操作 |
现象 |
结论 |
| 取与甲同学等量的试剂于另一支试管中,加热,再伸入带火星的木条 |
_______________________ , ________________________ |
猜想Ⅱ 成立 |
【反思与交流】
① 敞口放置的试剂容易变质,所以要_________保存;过氧化氢溶液见光易分解,所以要存放在___________(填试剂瓶类型)中。
② 二氧化锰在过氧化氢的分解中起催化作用。从本组实验中可得知,能改变化学反应速率的方法还可以_______________________。
甲同学取a克氯酸钾,乙同学取氯酸钾和二氧化锰的混合物(按质量比3:1)a克,二人同时进行加热。下列图示中能正确反映生成氧气质量(Y)与加热时间(X)关系正确的是
试题篮
()