某校化学兴趣小组进行粗盐(含有泥沙)提纯实验,并利用所得精盐配制100g20%的氯化钠溶液。
实验一:如图1是甲同学进行粗盐提纯实验的操作示意图。
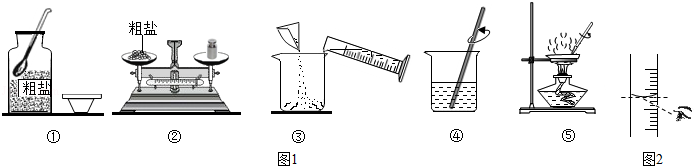
(1)操作①中的一处明显错误是 。
(2)操作⑤对应的实验中,停止加热的恰当时机是 。
(3)该同学实验中缺少过滤操作,在此操作中玻璃棒的作用是 。
实验二:乙同学用提纯得到的精盐配制100g20%的氯化钠溶液。
(4)配制时,除如图1提供的仪器外,还需要试剂瓶、镊子和 (填一种仪器名称)。
(5)若其他操作均正确,采用如图2所示观察方式量取水,则所配溶液的溶质质量分数 _ (填">"、"<"或"=")20%。
如图是初中化学的一些基本实验,请回答相关问题:

(1)A实验中热水的作用是 。(答一点即可)
(2)B实验反应的实质是 。
(3)C实验中澄清的石灰水没有变浑浊,原因是 。(答一点即可)
(4)D实验中两支蜡烛依次熄灭,说明二氧化碳具有的化学性质是 。
阿依、阿卓、阿牛春游时,发现了一株被太阳晒成紫红色的蒲公英,他们将其带回家洗净、捣碎,用阿达喝的老白干浸泡,再用纱布过滤,取其汁液,将其分成两份。已知紫红色蒲公英汁与紫色石蕊性质相同,请您预测:向一份中滴入食醋,会显 色,向另一份中滴加餐具洗洁精,会显 色。
中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱中和反应进行了如下研究。
【实验过程1】对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反 应,要证明它们之间确实发生了化学反应,可通过如图所示实验步骤进行操作。

请根据上图所示实验步骤填写实验报告:
实验步骤 |
实验现象 |
实验结论 |
①向试管中加入1~2ml稀氢氧化钠溶液 |
|
NaOH与HCl 发生了中和反应 |
② |
|
|
③ |
|
【实验过程2】对于某些有明显现象产生的中和反应,如稀盐酸与氢氧化铝的反应,观察到有 的现象,就可以说明中和反应已经发生。该反应的化学方程式为 。[提 示:氢氧化铝是不溶于水的白色固体,其化学式为Al(OH)3]
【实验反思】
(1)有同学提出也可以使用石蕊溶液代替酚酞溶液进行【实验过程1】的实验。你认为 (填“酚酞溶液”或“石蕊溶液”)更适合用于验证稀盐酸与稀氢氧化钠溶液发生中和反应,你的理由是 。
(2)对于没有明显现象出现的酸碱中和反应,我们可以借助 的变化,来判断是否反应或反应进行的程度。
科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g 6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
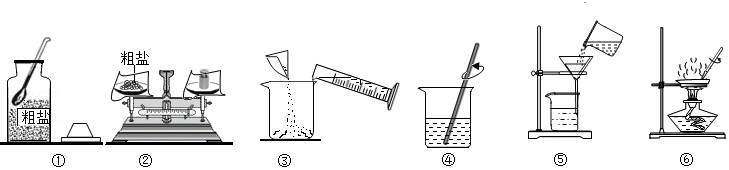
(1)如图中操作有错误的是 (填数字序号)。
(2)操作⑥中,当观察到蒸发皿中 时,停止加热。
(3)海水晒盐采用如图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度 。
实验二:用提纯得到的精盐配制50g 6%的氯化钠溶液
(1)计算。需要氯化钠 g,蒸馏水 mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会 6%(填">""<"或"=")。
(3)溶解。用玻璃棒搅拌的目的是 。
(4)装瓶、贴标签。
小科从标签得知雪碧成分中有水、二氧化碳、柠檬酸、柠檬酸钠等。查阅资料知道1体积雪碧中含有约3体积二氧化碳,柠檬酸的含量约为2.8g/1000mL.柠檬酸与碳酸钠反应的化学方程式为:
2C6H8O7+3Na2CO3═2C6H5O7Na3+3CO2↑+3H2O。
他用一瓶500mL的雪碧做了如下实验:。
实验步骤 |
步骤一 |
步骤二 |
步骤三 |
步骤四 |
操作过程 |
倒出三分之二雪碧,测其pH |
在剩余雪碧中加入约6g Na2CO3 |
立即盖上瓶盖,摇匀。 |
测溶液pH |
现象或结果 |
pH约为3 |
产生大量气泡 |
气泡消失,瓶子略瘪 |
pH约为9 |
【发现问题】CO2去哪儿了?
【提出猜想】①CO2被溶解了;②CO2与H2O发生了反应;③CO2与Na2CO3溶液发生了反应。小思否定了猜想①和②,其理由是 。
【设计实验】对猜想③进行实验探究。
实验编号 |
实验一 |
实验二 |
实验三 |
实验四 |
实验装置 |
|
|
|
|
操作过程 |
Na2CO3溶液中滴加CaCl2溶液 |
Na2CO3溶液中通入过量CO2后,滴加CaCl2溶液 |
收集一瓶CO2,加入30mL饱和Na2CO3溶液,盖上瓶盖摇匀 |
将实验三的溶液低温蒸发、干燥,得到的白色粉末按如图所示装置进行实验 |
实验现象 |
产生白色沉淀 |
无明显变化 |
瓶变瘪,瓶底有晶体析出 |
A试管口有水滴,澄清石灰水变浑浊 |
根据实验探究过程,回答下列问题:
(1)设计实验一的作用是 。
(2)实验四中A试管口略向下倾斜,其目的是 。
(3)根据实验探究得出:CO2与Na2CO3溶液反应的化学方程式: 。
实验技能是学习化学和进行探究活动的基础和保证。

(1)实验室配制50g质量分数为6%的NaCl溶液,用到的玻璃仪器除试剂瓶、量筒、胶头滴管外,还需要 。量取读数时,如图视线角度正确的是 (填序号)。
(2)请根据如图装置或操作回答相关问题。
①选取图2中的序号,表示粗盐提纯的正确操作顺序为 。操作B的名称是 ,该操作中当 时,应停止加热。
②实验室用高锰酸钾固体制取氧气时,可选用的发生装置是 (填序号)。
矿物资源的综合利用,可以节约资源与能源.黄铁矿的主要成分为二硫化亚铁(FeS 2),黄铁矿煅烧的化学方程式:4FeS 2+11O 2═2Fe 2O 3+8SO 2.产生的SO 2用于生产硫酸,矿渣(含有少量的硫元素)用于冶铁.
查阅资料:SO 2气体能使品红溶液褪色,能使澄清石灰水变浑浊,反应的化学方程式为SO 2+Ca(OH) 2═CaSO 3↓+H 2O.
(1)FeS 2中硫元素的化合价为 .矿渣在炼铁高炉内反应产生的高炉气含CO、CO 2、SO 2等气体,其中 是形成酸雨的气体.
(2)某化学兴趣小组为检验高炉气中的CO、CO 2、SO 2,设计了如图所示装置(不考虑其他气体对该实验的影响).
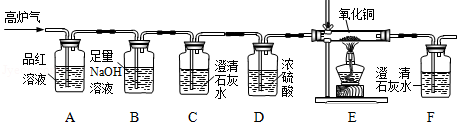
①该装置不能检验出的气体是 .
②装置B的作用是 .
③装置E中发生反应的化学方程式为 .
④确认高炉气中含CO的依据是 (填小写字母).
a.装置C中澄清石灰水变浑浊 b.装置C中澄清石灰水不变浑浊
c.装置E中黑色粉末变成红色 d.装置F中澄清石灰水变浑浊
(3)请指出该装置存在的一处明显缺陷 .
实验是科学探究的重要方式,请结合图示回答下列问题:
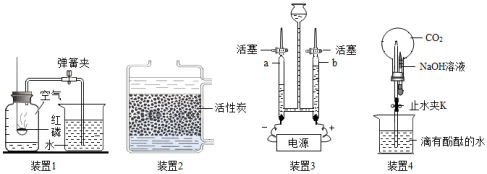
(1)装置1常用于实验室测定空气中氧气含量。请写出红磷燃烧的化学方程式 。
(2)装置2中的活性炭有 性,可用于净化水;常用 区别硬水和软水,生活中常用 的方法降低水的硬度。
(3)装置3常用于实验室电解水,与电源正极相连的玻璃管中收集的气体是 ;此实验可以证明水是由 组成的。
(4)装置4可用于研究CO2与NaOH溶液的反应。关闭弹簧夹K,将NaOH溶液全部挤入烧瓶,振荡;然后打开弹簧夹K。观察到的实验现象: 形成美丽喷泉,写出该反应的化学方程式 。
氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。

(1)实验一中,B试管中发生反应的化学方程式为 。
A、B两支试管中共同的实验现象是 。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是 (填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
【提出猜想】猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 |
实验现象 |
实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 |
|
猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 |
产生白色沉淀, 酚酞溶液变红 |
猜想2成立 |
【反思与评价】I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是 。
若要验证猜想2成立,需将Ca(OH)2溶液换成 溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是 (用文字叙述)
根据表中信息,请回答下列问题:
部分碱、酸、盐的溶解性表(20℃)
| 阴离子 阳离子 |
OH ﹣ |
NO 3 ﹣ |
Cl ﹣ |
SO 4 2 ﹣ |
CO 3 2 ﹣ |
PO 4 3 ﹣ |
| H + |
|
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
溶 |
| K + |
溶 |
溶 |
溶 |
溶 |
溶 |
溶 |
| Na + |
溶 |
溶 |
溶 |
溶 |
溶 |
溶溶 |
| Ba 2+ |
溶 |
溶 |
溶 |
不 |
不 |
不 |
| Ca 2+ |
微 |
溶 |
溶 |
微 |
不 |
不 |
| Cu 2+ |
不 |
溶 |
溶 |
溶 |
﹣ |
不 |
说明:"溶"表示那种物质可溶于水,"不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,"﹣"表示那种物质不存在或遇到水就分解了。
(1)CaCO 3属于 (填"可溶物"、"微溶物"或"不溶物")。
(2)表中可溶于水的硫酸盐有 种。
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应。若能,写出化学方程式;若不能,说明理由。
(4)某同学将盐酸倒入Ba(OH) 2溶液中,得到溶液甲。
①溶液甲中溶质的组成情况可能有 种。
②实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
| 方案编号 |
实验操作 |
实验现象 |
| 1 |
取少量溶液甲于试管中,加入铁粉 |
是否 |
b.探究溶液甲中是否含Ba(OH) 2
| 方案编号 |
实验操作 |
实验现象 |
| 2 |
取少量溶液甲于试管中,加入 溶液 |
是否产生蓝色沉淀 |
| 3 |
取少量溶液甲于试管中,加入Na 2SO 4溶液 |
是否产生白色沉淀 |
上述三个方案中有一个不合理,请指出不合理的方案编号并说明理由: 。
③欲从溶液甲中获得纯净的BaCl 2固体,应采取的简单操作是 。

某化学兴趣小组做粗盐中难溶性杂质去除的实验,实验过程如图所示。

(1)步骤①的名称是 。
(2)步骤②中,玻璃棒的作用是 。
(3)步骤③中,当观察到蒸发皿内出现 时,停止加热。
(4)将氯化钠与泥沙分离所采用的方法,利用了氯化钠具有 的性质。
在拓展性课程活动中,小明利用以下常见物品验证酸的一些性质:
白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、苏打(碳酸钠).
【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色.
【实验过程】
(1)在鸡蛋壳上滴加白醋,产生无色、无味的气体,该气体能使澄清石灰水变浑浊,则鸡蛋壳中一定含有 (用离子符号表示).
(2)小明知道酸能够与铁发生化学反应产生氢气,但当他将足量的白醋加入放有铁钉的容器中,没有看到明显的气泡产生.小明很疑惑,于是提出猜想:气泡不明显可能与酸的浓度和种类有关.要验证与酸的浓度有关,应选择下列试剂中的 (选填编号).
A.3%的盐酸 B.5%的醋酸 C.5%的盐酸
(3)小明利用已有物品还想验证酸与碱的反应,请你帮助完成下列实验设计.
| 步骤 |
操作 |
现象 |
| 1 |
将食品干燥剂加入适量清水中,搅拌后静置 |
放出大量的热 |
| 2 |
取步骤1中的上层清液,先加入牵牛花汁液, |
溶液由无色变为蓝色,再变为紫色,最后变为红色 |
【评价反思】科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学.
如图为“去除粗盐中难溶性杂质并计算产率”的实验操作示意图:

(1)请将上述操作进行合理排序: (填序号)、计算;请改正操作④中的错误 ;
(2)操作②中,用玻璃棒不断搅拌的目的是 ;
(3)过滤后,如果滤液仍然浑浊,其原因可能是 ;
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质如MgCl2、CaCl2,得到纯净的NaCl,还需依次用到NaOH溶液、Na2CO3溶液和稀盐酸(三种药品均过量);
①碳酸钠溶液要过量的原因是 ;②稀盐酸的作用是 。
酸、碱、盐是我们身边重要的化合物。请根据所学知识回答相关问题:
(1)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有 (填离子符号)。
(2)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式 。
(3)波尔多液是由硫酸铜和石灰乳等配成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点(一种难溶性碱),蓝色斑点的成分是 (填化学式)。
(4)下列试剂能将稀盐酸、氯化钠溶液、澄清石灰水三种溶液一次鉴别出来的是 (填序号)。
A.稀硫酸
B.酚酞溶液
C.碳酸钠溶液
试题篮
()