下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题。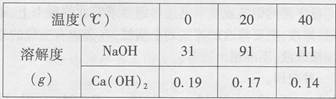
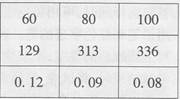
(1)从表中数据可以获得的信息是___________(写一条)。
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是_______;现有20℃是Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙______甲(填>、<、=)。
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答: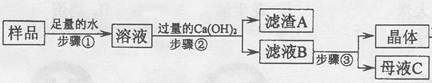
(Ⅰ)步骤①反应的化学方程式为________;加入过量Ca(OH)2的目的是______________。
(Ⅱ)滤液B中的溶质是__________、_________(写化学式);步骤③所包含的具体操作是加热浓缩、_______、过滤。
以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 |
H2O2溶 液浓度% |
H2O2溶液体积/mL |
温度℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| ③ |
30 |
5 |
35 |
|
2 |
49.21 |
| ④ |
30 |
5 |
55 |
|
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;从实验
和 对比可知,化学反应速率与温度的关系是: ;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量 (选填“减小”或“不变”或“增大”)。
试题篮
()