我国著名化工专家侯德榜创立了"候氏制碱法",促进了我国民族工业的发展。其生产原理是在氯化钠饱和溶液中通入氨气,再通入二氧化碳,使溶解度较小的碳酸氢钠从溶液中以沉淀的形式析出:
NaCl+NH 3+CO 2+H 2O═NH 4Cl+NaHCO 3↓
过滤出碳酸钠晶体,再受热分解得到产品:2NaHCO 3  Na 2CO 3+H 2O+CO 2↑
Na 2CO 3+H 2O+CO 2↑
(1)"侯氏制碱法"制得的"碱"是 (写化学式);
(2)根据化学方程式计算,5.85吨NaCl可制得8.4吨NaHCO 3,实际上从反应后的混合物溶液中析出NaHCO 3晶体的质量 8.4吨;(选填"大于"、"等于"或"小于")
(3)与"侯氏制碱法"不同的是,比利时科学家苏尔维在制碱过程中,向滤出NaHCO 3晶体后的混合溶液中加熟石灰以回收氨气:2NH 4Cl+Ca(OH) 2  CaCl 2+2NH 3↑+2H 2O
CaCl 2+2NH 3↑+2H 2O
请计算:NH 4Cl质量分数为20%的混合溶液5.35吨,完全反应后理论上可获得NH 3多少吨?
某科学兴趣小组在课余时间做了"开门大吉"的游戏,其规则是:每把钥匙代表一种试剂,每扇门代表需要鉴别的两种溶液,见如图。如果钥匙代表的试剂能够鉴别出门上代表的两种溶液,钥匙就能把门打开(每把钥匙只能使用一次),下列能够依次将四扇门打开的钥匙顺序是( )

| A. |
①②③④ |
B. |
④②③① |
C. |
④③②① |
D. |
①③②④ |
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
某拓展性学习小组在学校科学实验创新比赛中,做了一个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C颈插有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注入氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,并对此作出合理的解释。

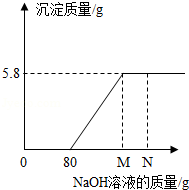
工业盐酸中通常溶有少量的FeCl 3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl 3与NaOH反应的化学方程式为FeCl 3+3NaOH═Fe(OH) 3↓+3NaCl.请回答下列问题:
(1)FeCl 3与NaOH恰好完全反应时,生成沉淀的质量是 g。
(2)该工业盐酸中HCl的质量分数是多少?(写出计算过程)
(3)取l00g该工业盐酸稀释成HCl质量分数为10%的稀盐酸,需加多少克水?(写出计算过程)

人体所需的维生素C(化学式为C 6H 8O 6)主要从蔬菜、水果中摄取,计算:
(1)维生素C中碳、氢、氧三种元素质量的最简整数比为 。
(2)现有溶质质量分数为1%的维生素C的溶液300g,若配制成溶质质量分数为0.3%的维生素C的溶液,问需要加水的质量是多少。(写出计算过程)
化学兴趣小组同学设计如下四组实验,在相同条件下,比较两种物质催化效果,其中观察效果较差是
| A.第一组同时实验,观察比较过程中两个气球体积变化 |
| B.第二组同时实验,观察比较过程中两者产生气泡快慢 |
| C.第三组分两次实验,看木条是否能复燃 |
| D.第四组分两次实验,比较收集一定体积气体所需要时间 |
某校同学开展了如图所示“检验溶液酸碱性”的实验活动。
把自制的紫罗兰汁按如图所示分别滴加到试管中,观察到的现象如下表所示:
溶液 |
白醋 |
盐酸 |
食盐水 |
草木灰水 |
石灰水 |
加入紫罗兰花汁后的颜色 |
红色 |
红色 |
紫色 |
蓝色 |
蓝色 |
请回答下列问题:
(1)由表可知,紫罗兰汁能作酸碱指示剂,若其遇到稀硫酸显示的颜色是 。
(2)草木灰水中滴加酚酞试液后显示的颜色为 ,原因是其溶液显 (填“酸性”“中性”或“碱性”)。
(3)将实验中的盐酸和石灰水混合,反应的化学方程式为 。
某学校兴趣小组在参与"五水共治"行动中,考察了某工厂的废水处理工程,并取该厂未经处理的废水样品进行测定分析:
(1)用紫色石蕊试液检验废水的酸碱性,石蕊试液呈 色,说明该废水显酸性.
(2)另取废水样品少量,滴加适量Ba(NO 3) 2,有白色沉淀产生,说明该废水中一定含有的酸根离子是 .
(3)同学们进一步了解到该废水中中含有一种酸,为测定其所含酸的质量分数,取该废水200克于烧杯中,逐渐加入硝酸钡溶液,生成的沉淀质量与加入硝酸钡溶液的质量关系如图所示,请计算废水中硫酸的质量分数.(假设该废水中的其他物质均溶于水且不与硝酸钡溶液反应).

向100克MgCl 2和HCl的混合溶液中,逐滴加入10%的氢氧化钠溶液,反应情况,如图所示。
(1)当滴加氢氧化钠溶液的质量至N点时所得溶液的pH值为 (填编号);
A.大于7 B.等于7 C.小于7
(2)通过计算,确定M点的值,写出计算过程。
下列说法合理的有( )
①高炉炼铁炼得的是纯铁
②打开汽水瓶盖,看到气泡逸出,说明气体的溶解度随压强的减小而减小
③向充满CO 2气体的软塑料瓶中倒入半瓶水,拧紧瓶盖,振荡,塑料瓶变瘪,说明CO 2能与水发生反应
④某同学将一定量的Na 2CO 3和Ba(OH) 2溶液混合,要想检验反应后Ba(OH) 2是否过量,选用Na 2CO 3溶液、Na 2SO 4溶液或FeCl 3溶液均可
⑤向一定量的NaCl、MgSO 4和HCl的混合溶液中逐滴加入NaOH溶液,如图表示加入NaOH溶液的质量与某些物质的质量变化关系。则m点对应的溶液中有三种溶质,a可表示NaCl或H 2O的质量变化情况

| A. |
1个 |
B. |
2个 |
C. |
3个 |
D. |
4个 |
某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下

请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 肥;
(2)该同学制得氧气的质量 g;
(3)计算滤液中溶质质量分数。
已知:①NaHCO3 固体受热分解 2NaHCO3 Na2CO3+CO2↑+H2O;②Na2CO3 受热不分解。回答下列问题:
(1)关于 NaHCO3 固体的叙述错误的是 (填标号)。
A.俗称小苏打 B.难溶于水
C.可与稀盐酸发生反应 D.是发酵粉的主要成分之一
(2)欲测定某 NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将 5.0g 该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
①NaOH溶液的pH 7(填“>”、“=”或“<”),用该溶液将生成的CO2完全吸收,发生反应的化学方程式为 。
②由图中数据可知,上述5.0g NaHCO3 样品完全分解产生CO2的质量为 g,产生H2O的质量是 g。
③计算该样品中NaHCO3的质量分数(根据化学方程式写出完整的计算步骤)。

我国在2017年"世界环境日"(6月5日)确定的主题是"绿水青山,就是金山银山".华雪与同学们积极参加了这一主题的活动,在老师的指导下,他们对一造纸厂排放的污水进行检测,发现其主要的污染物为NaOH.为了测定污水中NaOH的含量,他们首先把溶质质量分数为98%(密度1.84g/cm 3)的浓硫酸20g,稀释为质量分数为10%的硫酸;然后取80g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应).请计算:
(1)把20g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是 g.
(2)污水中所含NaOH的质量分数是多少?(写出计算过程)
(3)取80g该污水于烧杯中放置几天后,若其中的氢氧化钠全部转化为碳酸钠.则此时应逐滴加入10%的硫酸 克才能使碳酸钠恰好完全变成硫酸钠.
试题篮
()