某学习小组用黑枸杞提取液作了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
颜色 |
粉红 |
粉红 |
粉红 |
浅紫 |
浅紫 |
紫 |
紫 |
蓝 |
蓝 |
深蓝 |
深蓝 |
灰绿 |
黄 |
黄棕 |
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。
实验结果如下:
物质 |
稀盐酸 |
牛奶 |
蒸馏水 |
炉具清洁剂 |
颜色 |
粉红 |
紫 |
紫 |
黄 |
回答下列问题:
(1)炉具清洁剂的pH为 。
(2)根据实验现象,不能确定牛奶呈中性的理由是 。
(3)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴入稀盐酸至过量,观察到的实验现象为 。
某化学兴趣小组利用“化学喷泉”设计了如下实验:20℃时,用250mL圆底烧瓶收集一瓶纯净的CO2,按如图组装装置。用注射器缓缓注入3mL NaOH溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、E装置中发生连锁反应。回答下列问题:

(1)图中仪器X的名称是 。
(2)注入NaOH溶液后,烧瓶内发生反应的化学方程式是 。
(3)“连锁反应”后,C试管中溶液的颜色变化为 ;E试管中的现象为 ,反应的化学方程式为 。
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有NaOH剩余,你认为是否正确? ,说明原因: 。
酸碱盐在工农业生产和生活中应用广泛,请用所学化学知识回答问题。
(1)日常生活中有以下常见物质:白醋、纯碱、苛性钠、小苏打、硫酸铵,其中属于碱的是 (填上述物质)。将少量无色酚酞溶液滴加到碱溶液中,溶液变 。
(2)如饮食不当,胃会分泌出大量胃酸,服用含有下列哪种物质的药物可以中和过多胃酸,写出反应的化学方程式 。
A.NaOH B.Na2CO3 C.Al(OH)3
(3)某氯化钠样品中,可能含有杂质:BaCl2、MgCl2、Na2SO4中的一种或几种,某校课外化学兴趣小组的同学进行实验探究杂质成分,探究过程如图(已知氢氧化镁难溶于水):

根据以上实验信息,用 操作方法,可将上述实验过程中产生的白色沉淀与溶液分离,加入适量NaOH溶液的目的是 ,写出杂质与Na2SO4溶液反应的化学方程式 。
根据如图所示实验,回答下列问题。
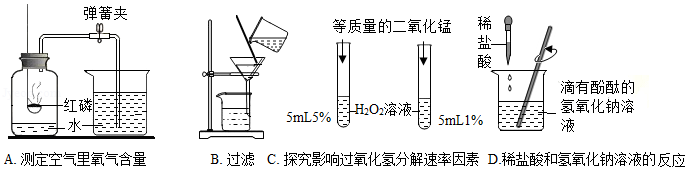
(1)A中实验可得出关于空气中氧气含量的结论是 。
(2)B中过滤后,滤液仍然浑浊可能的原因是 (答一点即可)。
(3)C中两支试管内产生气泡速度不同,由此可知影响过氧化氢分解速率的因素是 。
(4)D中溶液由红色变成无色时,溶液中溶质的组成最多有 种情况。
二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加SO2可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量≤259mg/L。
(1)SO2作为食品添加剂须严格控制用量的原因是 。
(2)为检测某国产葡萄酒SO2中的含量是否符合国家标准,进行如下实验:
步骤1 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(该指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈 色。
②向10g 30%的H2O2溶液中加入 g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。
化学兴趣小组的同学们在老师的带领下走进实验室,开展实验活动。
(1)实验室依次编号为1、2、3、4的药品柜中,分别存放常见的酸、碱、盐和酸碱指示剂。小刚欲使用熟石灰,他需从 号柜中取出。
(2)小刚发现盛放Na2CO3与NaCl两种溶液的试剂瓶标签脱落,为鉴别两种溶液,分别取样于试管中,加入无色酚酞溶液,若为Na2CO3,则观察到溶液变为 色。
(3)小文从柜中取出标有“10% NaOH溶液”的试剂瓶,取少量样品加入试管中,向其中滴入稀盐酸,发现产生气泡,判断该NaOH溶液中有Na2CO3,用化学方程式表示NaOH溶液变质的原因: 。
小文同学对变质的NaOH溶液进行如下一系列实验,实现药品再利用。
I.测定NaOH溶液中Na2CO3的质量分数
[实验操作]取40.0g 10%的NaOH溶液样品进行如图所示的实验。

[数据处理]
①所取用盐酸(溶质质量分数7.3%)的质量理论上不少于 g。
②如图中,反应前后天平示数相差1.1g,计算NaOH溶液中Na2CO3的质量分数(写出计算过程)。
Ⅱ.变质的NaOH溶液再利用
小文将剩余NaOH溶液倒入烧杯中,加入经计算所需的熟石灰粉末,充分搅拌、静置,过滤,得到NaOH溶液和滤渣。充分搅拌的主要目的是 。
(4)实验结束后,同学们将实验产生的废液和废渣倒入指定的烧杯中,得到无色溶液和白色沉淀,溶液中除一定存在的溶质外,可能存在的溶质是 。
同学们再次实验,确认成分后,对废液回收利用,绿色排放。
小红和小明通过合作交流,完成了CO2的实验室制取,并进行了相关问题的思考和讨论。(查阅资料:氯化钙溶液呈中性)
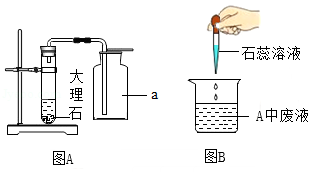
(1)仪器a的名称是 ;
(2)块状大理石装入试管内的基本操作是 ;
(3)试管内发生反应的化学方程式是 ;
(4)烧杯中溶液变红,他们分析废液呈酸性的一种原因是 。
我们通过学习知道:钠原子结构示意图 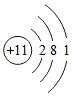 ,钠原子在化学反应中易 电子,成为 (填名称)。
,钠原子在化学反应中易 电子,成为 (填名称)。
(1)"在金属活动顺序里,位于前面的金属能把位于后面的金属从其盐溶液里置换出来",金属钠排在铜的前面。有的同学据此推测:钠能从蓝色硫酸铜溶液中把铜置换出来。教师按照下列图示顺序进行演示实验,并记录实验现象:

①由以上实验现象得出结论:因为反应中没有 色的物质生成,所以金属钠 (填:"能"或"不能")把铜从硫酸铜溶液中置换出来。
②对实验涉及的物质进行分析:硫酸铜溶液中溶剂为水,溶质为 (填化学式)。钠与硫酸铜溶液反应后培养皿中所含元素有:Na、Cu、H、O、 (填元素符号)五种元素。
查阅资料得知:"蓝色絮状难溶物"是一种学过的碱,该物质的名称是 。
(2)有的同学又产生新的疑问:钠能否与水发生反应?生成物是什么?
教师为解答学生的疑惑,又设计并进行如下实验,同时记录有关现象:

请结合如图所示信息,回答下列问题:
①用手触摸图3中烧杯外壁,感觉烫手,说明钠与水发生的是 (填:"吸热"或"放热")反应。
②从"图3"中可以断定:液体中出现红色说明反应后液体显 性,结合液体中所含元素,继而推断有 (填化学式)生成。另外,钠与水反应还生成一种可燃性气体单质。请写出钠与水反应的化学方程式: 。
造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

6105n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
(1)不同实验对反应速率有不同要求。某同学探究CO2制取实验,按要求答题。
限选控制反应速率的方法:①反应物的浓度②反应物的状态
限选试剂:A.稀盐酸B.浓盐酸C.块状石灰石D.碳酸钠溶液E.粉末状石灰石
填写下表并回答相关问题。
实验名称 |
控制速率的方法 |
所选用的最佳试剂 |
灭火器反应原理 |
① |
和D |
CO2的实验室制法 |
|
A和C |
写出灭火器反应原理的化学方程式 。
(2)已知:CO2和SO2既有相似性,又有差异性。
实验一:水槽中滴入紫色石蕊,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2 (填“>”或“<”)CO2,试管内溶液变成 色。
实验二:已知镁条在CO2中剧烈燃烧的化学方程式为:2Mg+CO2 2MgO+C.试推测镁条在SO2中燃烧的现象为:剧烈燃烧, 。

某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。如图为依据实验数据绘制的 V(盐酸)﹣pH图。
(1)滴加盐酸的体积为V1时,溶液呈什么颜色?
(2)滴加盐酸的体积为V2时,溶液中除了水分子外,主要的微粒有哪些?
(3)举出中和反应的一个应用实例。

实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)

(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈 性。
(2)上述实验中产生的二氧化碳气体质量为 克。
(3)计算甲瓶固体样品中碳酸钠的质量分数。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因。
实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)

(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈 性。
(2)上述实验中产生的二氧化碳气体质量为 克。
(3)计算甲瓶固体样品中碳酸钠的质量分数。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因。
某校举行科学实验操作考查,由学生抽签确定考察的实验内容,要求根据提供的实验器材完成相关实验。
(1)A组实验有:①过滤含泥沙的食盐水;②蒸发氯化钠溶液获得晶体;③用实验室方法制取一瓶二氧化碳,甲同学抽到的是A组中的一个实验,需要如下器材:
则他抽到的实验是 (选填序号)。
(2)乙同学抽到的是B组中的一个实验:配制50克10%的氯化钠溶液,为完成该实验,他应称取固体氯化钠 克。
(3)丙同学抽到的是B组中另一个实验:验证硫酸和氢氧化钠溶液的酸碱性,用到的试剂有:稀硫酸、氢氧化钠溶液、紫色石蕊试液。实验结束后,他将实验后的溶液全部倒入废液缸,混合溶液呈蓝色,则混合溶液中除石蕊外还含有的溶质为 (写化学式)

某学校兴趣小组在参与"五水共治"行动中,考察了某工厂的废水处理工程,并取该厂未经处理的废水样品进行测定分析:
(1)用紫色石蕊试液检验废水的酸碱性,石蕊试液呈 色,说明该废水显酸性.
(2)另取废水样品少量,滴加适量Ba(NO 3) 2,有白色沉淀产生,说明该废水中一定含有的酸根离子是 .
(3)同学们进一步了解到该废水中中含有一种酸,为测定其所含酸的质量分数,取该废水200克于烧杯中,逐渐加入硝酸钡溶液,生成的沉淀质量与加入硝酸钡溶液的质量关系如图所示,请计算废水中硫酸的质量分数.(假设该废水中的其他物质均溶于水且不与硝酸钡溶液反应).

试题篮
()