物质的性质决定其用途,下列因果关系不成立的是( )
| A. |
稀有气体化学性质稳定,可用作保护气 |
B. |
干冰升华吸热,可用于人工降雨 |
| C. |
熟石灰呈碱性,可用来改良酸性土壤 |
D. |
稀硫酸能与金属反应,可用来除锈 |
生活离不开化学。现有①氮气,②活性炭,③甲烷,④盐酸,⑤石油,选择适当的物质填空(写序号):能吸附异味的物质是 ;食品包装袋中常用来防腐的是 ;可用于金属表面除锈的是 ;属于化石燃料的是 ;天然气的主要成分是 。
下列关于酸的说法错误的是( )
| A. |
浓硫酸具有吸水性,浓盐酸具有挥发性 |
| B. |
稀盐酸和稀硫酸都可用于金属除锈 |
| C. |
稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色 |
| D. |
稀硫酸能够与活泼金属反应制取氢气 |
化学与人体健康、社会发展有密切关系.下列有关说法正确的是( )
| A. |
人体胃液中有盐酸,可帮助消化 |
| B. |
煤、石油和天然气都是可再生能源 |
| C. |
人体缺少铁元素易造成甲状腺肿大 |
| D. |
糖类和维生素都是为人体提供能量的主要物质 |
下列有关硫酸的说法,正确的是( )
| A. |
打开盛有浓硫酸的试剂瓶塞,瓶口出现白雾 |
| B. |
浓硫酸不慎沾到皮肤上,立即用大量的水冲洗,然后再涂上3%﹣5%的碳酸氢钠溶液 |
| C. |
实验室用稀硫酸和石灰石制取二氧化碳 |
| D. |
把铜片放入稀硫酸中,产生大量气泡 |
如图所示的四个图象,分别对应四种过程,其中不正确的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
某工业品盐酸的溶质的质量分数为37%.请回答:
(1)将该盐酸敞口露置于空气中,一段时间后,其溶质的质量分数 37%(填“大于”“小于”或“等于”);
(2)该盐酸因含有少量Fe3+而显黄色(其他杂质忽略不计)。现取少量样品,与适量硝酸银溶液恰好完全反应。经实验测得,反应后溶液中的H+和NO3﹣的个数比为91:94,则该盐酸中Fe3+和Cl﹣的个数比为 。
下列物质与对应用途不合理的是( )
A.熟石灰﹣改良酸性土壤B.石墨﹣制电极
C.稀硫酸﹣金属除锈D.氧气﹣做燃料
(1)盐酸、硫酸是常见的两种酸。①打开装浓盐酸的试剂瓶时,瓶口出现白雾,说明浓盐酸具有 性。②用水稀释浓硫酸时, 并用玻璃棒不断搅拌即可。
(2 )如图是化肥硝酸铵包装袋上的部分说明:
①从说明上可以判断硝酸铵应具有的性质有 (填字母)。
A.易溶于水 B.撞击易爆炸 C.受热易分解
②若把硝酸铵溶于水配成溶液并用 pH试纸检测溶液酸碱性,发现常温下溶液的pH=6,则该盐溶液呈 (填“酸性”、“碱性”或“中性”)。
③硝酸铵与碱反应生成硝酸盐,写出硝酸铵与熟石灰在加热条件下反应的化学方程式 。

下列图象不能正确反映其对应变化关系的是( )
A.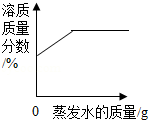 某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
B. 一定质量的红磷在密闭容器中燃烧
一定质量的红磷在密闭容器中燃烧
C.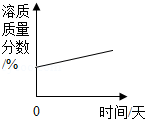 将一瓶浓硫酸露置于空气中
将一瓶浓硫酸露置于空气中
D.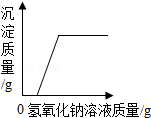 向一定质量的氯化镁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
向一定质量的氯化镁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
下列实验现象描述不正确的是( )
A.将铁粉加入CuSO4溶液,溶液由蓝色变为黄色
B.硫在氧气中燃烧发出明亮的蓝紫色火焰
C.打开盛浓盐酸的试剂瓶,瓶口出现白雾
D.磷在空气中燃烧产生大量白烟
如图所示,电子秤上的量筒中分别盛有蒸馏水、浓硫酸,放置一段时间。
(1)A中示数变小,从微粒的角度解释其原因是 。
(2)B中示数 (填“变大”“不变”或“变小”),其原因是 。

某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如表,回答下列问题。
| 时间 |
质量/g |
|||||
| |
水 |
饱和石灰水 |
稀盐酸 |
浓硫酸 |
氯化钠浓溶液 |
氯化钙浓溶液 |
| 1天 |
8.16 |
8.37 |
8.64 |
11.18 |
9.38 |
10.25 |
| 2天 |
5.76 |
5.94 |
6.69 |
12.55 |
8.47 |
10.33 |
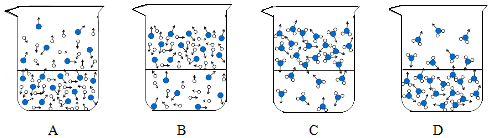
(1)下列图示能反映水在空气中放置时发生变化的微观示意图是 (填字母序号)
(图中  表示氧原子,○表示氢原子)
表示氧原子,○表示氢原子)
(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式 。
(3)为研制一种安全、环保的除湿剂,可选择上表中的 (填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体,则该溶液是 (填"饱和"或"不饱和")溶液。(已知该温度下氯化钠的溶解度为36.1g)
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是 。
②为验证甲同学的猜想是否正确,设计实验方案: 。
(6)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,由此能否计算所得溶液中溶质组成?若能,请计算其组成;若不能,请补充完成实验方案设计,同时说明需要测定的数据(用a表示),并计算a的取值范围。(不要求写出计算过程)
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
试题篮
()