某学习小组用黑枸杞提取液作了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
颜色 |
粉红 |
粉红 |
粉红 |
浅紫 |
浅紫 |
紫 |
紫 |
蓝 |
蓝 |
深蓝 |
深蓝 |
灰绿 |
黄 |
黄棕 |
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。
实验结果如下:
物质 |
稀盐酸 |
牛奶 |
蒸馏水 |
炉具清洁剂 |
颜色 |
粉红 |
紫 |
紫 |
黄 |
回答下列问题:
(1)炉具清洁剂的pH为 。
(2)根据实验现象,不能确定牛奶呈中性的理由是 。
(3)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴入稀盐酸至过量,观察到的实验现象为 。
H2SO4是一种重要的化工原料。
(1)H2SO4溶液的pH 7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法 ;
(2)浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是 (填写序号);
①H2
②CO2
③NH3
④HCl
(3)实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2,请写出该反应的化学方程式: ;
(4)向160g含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,产生的沉淀质量与加入NaOH溶液质量的关系如图所示,请写出b点对应溶液的溶质 (填写化学式),原混合溶液中CuSO4的质量分数是 。

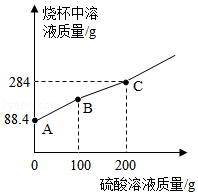
现有盛88.4g Na2CO3和NaOH混合溶液的大烧杯,向其中滴加质量分数为9.8%的H2SO4溶液,充分搅拌,烧杯中溶液的质量与滴加H2SO4溶液的质量关系如图所示,回答下列问题:
(1)写出AB段发生反应的化学方程式 。
(2)BC段可以观察到大烧杯的溶液中有气泡产生,则生成气体的质量为 g。
(3)B点时,大烧杯中的溶液pH 7(填“>”、“=”或“<”)。
(4)C点时,所得溶液为不饱和溶液。求溶液中溶质的质量分数。(写出计算过程)
黄铜(铜和锌的合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80克19.6%的稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
实验次数 |
1 |
2 |
3 |
4 |
稀硫酸的用量/克 |
20 |
20 |
20 |
20 |
剩余固体的质量/克 |
20.0 |
17.4 |
14.8 |
13.5 |
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH 7(选填“>”“=”或“<”)。
(2)配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克/厘米3)多少毫升?(精确到小数点后一位)
(3)通过计算说明该黄铜螺母的材料性能是否优良。
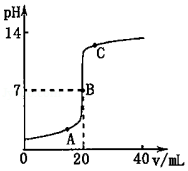
某同学在做中和反应实验时,用pH传感器测得溶液的pH变化如图所示,回答下列问题。
(1)向A点溶液中滴加紫色石蕊溶液的现象是 。
(2)曲线上 点表示酸和碱恰好完全反应。
(3)C点溶液中含有 种溶质。
铅蓄电池在生产、生活中使用广泛。其构造示意图如图1,回答下列问题:
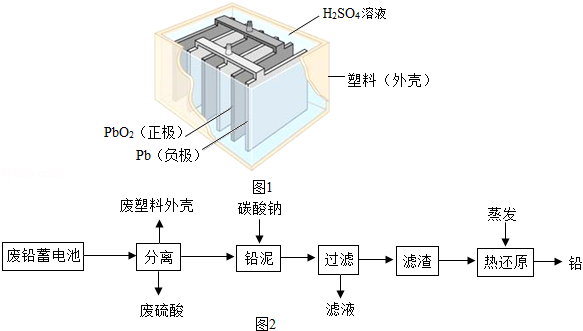
(1)铅蓄电池充电时是将电能转化为 (填序号)。
a、机械能 b、热能 c、化学能
22442O,据此可知,铅蓄电池在放电时,溶液的pH不断 (填“增大”、“减小”或“不变”)。
(3)如图2是回收废铅蓄电池的一种工艺流程:
①从材料分类角度看,塑料是一类 材料。
543543244242+2HF,反应产物中可用作化肥的物质是 。
③如表是一些金属熔点的数据:
金属 |
锡 |
铅 |
铋 |
镉 |
熔点∕℃ |
231.9 |
327.5 |
271.3 |
320.9 |
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为 (填序号)
A.300﹣320℃
B.230﹣250℃
C.60﹣80℃
D.20﹣40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
物质 |
3 |
2 |
3 |
NaOH |
市场参考价(元/kg ) |
1.8 |
2.0 |
6.5 |
11.5 |
32444,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择 (填序号)。
3 2 3 d、NaOH。
向硫酸中滴加氢氧化钠溶液并不断搅拌,如图为反应时溶液pH变化的示意图。
(1)请写出该反应的化学方程式。
(2)加入NaOH溶液a mL时,溶液中含有哪些溶质?
(3)若将b mL该氢氧化钠溶液滴入到与硫酸相同质量、相同质量分数的盐酸中,请判断反应后溶液的酸碱性。

某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。如图为依据实验数据绘制的 V(盐酸)﹣pH图。
(1)滴加盐酸的体积为V1时,溶液呈什么颜色?
(2)滴加盐酸的体积为V2时,溶液中除了水分子外,主要的微粒有哪些?
(3)举出中和反应的一个应用实例。

水是人类宝贵的资源.
(1)下列物质加入水中能形成溶液的是 ,能形成乳浊液的是 .(填序号)
a.植物油 b.蔗糖 c.粉笔灰
(2)下列溶液pH>7的是 ,pH<7的是 .(填序号)
a.食盐水 b.白醋 c.肥皂水
(3)NaCl溶于水,难溶于植物油;NaCl在热水中溶解的质量比在等质量的冷水中溶解的质量大.这说明,物质的溶解能力与 和 有关.
(4)净化水常用的方法有沉降、过滤、吸附和蒸馏水,活性炭在净水器中能起到过滤和 的作用,从盐水中获得饮用水,可采取的方法是 .
小吴对化学实验有浓厚的兴趣,设计了如下实验装置进行实验,按要求填空.

①仪器a的名称 ;可用于实验室制取O2的发生装置有 (填装置编号,下同);实验室制取CO2的发生装置有 ;用C装置收集CO2时,气体应从C装置的 端进入(填“b”或“c”).
②实验室制取H2的化学方程式为 .
③小吴D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈 性(填“酸”、“碱”或“中”).
④小吴用E装置探究CO2能否与碳酸钠溶液反应,他做了两组对比实验:第一组用胶头滴管向广口瓶中加入2 mL水,发现气球鼓起不明显;第二组用胶头滴管广口瓶中加入2 mL一定质量分数的碳酸钠溶液,发现气球迅速鼓起.他得出的结论是:CO2能与碳酸钠溶液反应,该反应的化学方程式为 .
阅读下列科普短文,回答下列问题.
生活中,我们常常能品尝到酸酸的食物,比如柠檬、酸奶…,因此,人们常认为有酸味的物质就是酸.但是,这种判断方法是错误的,在化学世界里,“酸”是在水中解离出的阳离子全部为H+的化合物,而“碱”是在水中解离出的阴离子全部为OH﹣的化合物,二者一见面,就会“水火不容”﹣﹣结合成水.
我们平时吃柠檬、苹果的时候感觉到酸酸的,那它们是酸性食物吗?答案:不是.因为判断食物的酸碱性,是根据食物进入人体后生成的最终代谢物的酸碱性而定.例如,酸性食物有肉、蛋、鱼、油脂、糖类等;碱性食物有蔬菜、茶叶、水果(高糖水果除外)、豆制品、牛奶等.
(1)下列物质属于酸的是 .
A.硫酸 B.碳酸氢钠 C.醋酸
(2)请写出有氯化钠生成的中和反应的化学方程式 .
(3)研究发现,多吃碱性食物有益健康.判断食物的酸碱性的依据是 .
A.人体的味觉
B.食物溶于水中的酸碱性
C.食物在体内最终代谢物的酸碱性.
取NaOH和NaCl的混合物3.63克放入烧杯中,加水溶解配制成70克溶液。向该溶液滴加溶质质量分数为7.3%的稀盐酸,测得溶液pH与滴入稀盐酸的质量关系如图所示。
(1)当滴入稀盐酸的质量为11.2克时,溶液的pH 7(填“>”、“<”或“=”);此时溶液中的溶质是 (填化学式)。
(2)当pH=7时,计算该溶液中溶质的质量分数。(写出计算过程)

2019年春节起,常州大部分地区禁止燃放烟花爆竹,开启了龙城环保新时代。
(1)“禁止燃放烟花爆竹”的安全标志是 。

(2)禁止燃放烟花爆竹不仅可以减少噪声污染、火灾等,还以减少SO2和 等空气污染物的排放,提升空气质量。
(3)爆竹中常含有硫、硝酸钾和木炭的混合粉末,点燃后生成硫化钾(K2S)、氮气和二氧化碳,该反应的化学方程式为 。含硫燃料燃烧产生的SO2会形成 型酸雨,酸雨的pH (填序号)。
A.小于5.6 B.等于7 C.大于7
试题篮
()