粗盐中除了含有NaCl外,还含有少量Na2SO4、CaCl2、MgCl2及泥沙等杂质。如图是常用的粗盐精制操作流程:
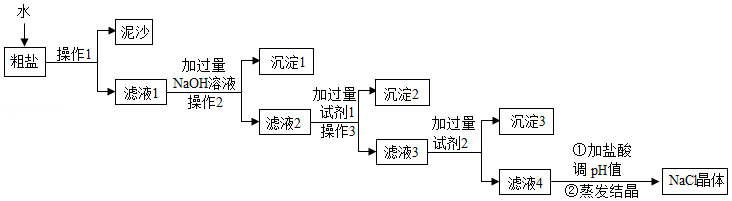
回答下列问题:
(1)操作1相当于实验室中的 操作;
(2)沉淀1的化学式为 ;
(3)加入过量试剂1的目的是 ;
(4)滤液4中含有的阴离子是 (填离子符号)。
酸、碱、盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出 (填字母)。
a.H2O b.H2 c.H+ d.OH﹣
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是 。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图1,当滴入溶液为V2mL时,所得溶液中溶质的化学式为 ,所得溶液能使紫色石蕊溶液变成 色。
(4)氯化钠是生活中常见的盐。为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如图2实验方案:
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和 。
②以上方案中有关反应的化学方程式为 (写一个即可)。
③写出溶液乙中含有的杂质,并将以上方案补充完整
。
(5)某实验室用20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液40g,洗涤后的溶液呈中性,请计算该一定量石油产品中H2SO4的质量。
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
(2)若要除去食盐固体中含有的少量CaCl2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
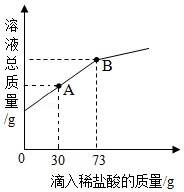
(3)在一烧杯中盛有Mg(OH)2和MgCl2的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).

盐城盛产海盐,某化学兴趣小组同学在市场购到粗盐,带回实验室进行提纯。

(1)在溶解、过滤、蒸发等操作中,均用到的玻璃仪器是 (填仪器名称)。
(2)配制50g质量分数为6%的NaC1溶液,需称量NaCl固体 g,若用粗盐配制上述溶液,则所配溶液中NaC1的质量分数会 (填“偏大”、“偏小”或“无影响”)。
探究活动:以NaC1为原料可以制取金属钠。兴趣小组同学认为Na是活泼金属,能与CuSO4等盐溶液反应,生成相应的金属单质。
[提出问题]Na与CuSO4溶液反应,是否有Cu生成?
[设计实验]兴趣小组同学在老师的指导下,设计如图1装置进行实验。
Ⅰ.向大试管中加入一定体积煤油。
Ⅱ.用小刀切一小块钠,放入大试管,塞上橡皮塞。
Ⅲ.打开活塞,通过长颈漏斗向试管中加入CuSO4溶液,使煤油的液面升至胶塞,关闭活塞,观察现象。
[实验现象]
(1)Na在煤油与溶液交界处上下来回振动,表面产生气泡,逐渐变小直至消失。
(2)溶液颜色逐渐变淡,有蓝色絮状沉淀和少量黑色固体生成。
(3)打开活塞,用燃着的木条放在尖嘴管口处,气体被点燃。
[查阅资料]①Na通常存放在煤油中 ②煤油不溶于水且不与水反应
③2Na+2H2O=2NaOH+H2↑ ④Cu(OH)2 CuO+H2O
CuO+H2O
[实验分析]
(1)根据上述信息,可获知金属钠的物理性质是 (答出一点即可)。
(2)实验中长颈漏斗的作用 (填数字序号)。
①便于添加CuSO4溶液
②收集气体
③防止压强过大冲开活塞
(3)对于产生的气体,有些同学猜想是H2,有些同学猜想是SO2.小组同学经过讨论,排除了SO2,理由是 ,经过进一步实验,确认气体是H2。
(4)将反应后的混合物过滤,向滤渣滴加足量稀硫酸,滤渣完全溶解。写出滤渣与稀硫酸反应的化学方程式(写出一个即可) 。
[实验结论]Na与CuSO4溶液反应,无Cu生成。
[实验反思]Na与CuSO4溶液反应无Cu生成,原因可能是 。
[定量分析]另取一定量上述CuSO4溶液,完成下列实验。利用数据,计算无色溶液的溶质质量分数。(写出计算过程,滴入的酚酞溶液质量忽略不计。)
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
22的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).
酸、碱、盐在生产和生活中有广泛的应用。
(1)焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为 (填字母代号)。
a.纯碱 b.烧碱 c.苏打 d.小苏打
(2)如图1是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将 (填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②滴入溶液体积为V2mL时,溶液中的溶质为 。
(3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图2方案:

①过滤用到的玻璃仪器有烧杯、玻璃棒和 。
②写出加入Ba(OH)2溶液时反应的化学方程式 。(提示:微溶物不形成沉淀)
③溶液X中含有哪些杂质?请设计实验加以证明 。(简要写出实验步骤和现象)
(4)为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。
试题篮
()