X、Y、Z三种物质有如图所示转化关系,“→”表示反应一步实现,部分物质和反应条件已略去。下列表中各组物质不符合转化要求的是( )
物质选项 |
X |
Y |
Z |
A |
H2O2 |
H2O |
O2 |
B |
HCl |
H2 |
H2O |
C |
Fe2O3 |
FeCl3 |
Fe(OH)3 |
D |
Na2SO4 |
NaCl |
NaNO3 |

A.AB.BC.CD.D
碲(Te)广泛用于彩色玻璃和陶瓷工艺。用某工业废渣(主要含有TeO2、少量Ag、Au)为原料制备碲的一种工艺流程如图:
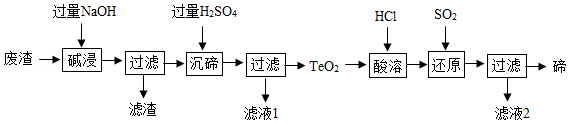
回答下列问题:
(1)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式 。
(2)滤液1中的两种溶质是H2SO4和 (填化学式)。
(3)上述工艺流程中设计“废渣→…→TeO2”的目的是 。
(4)“酸溶”后,在TeCl4溶液中通入SO2,反应生成碲和初中化学中两种常见的酸,则该反应的化学方程式是 。
金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成份为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
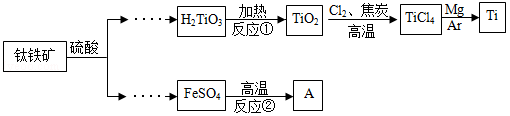
(1)反应①的化学方程式为 。
(2)TiO2与焦炭(C)和Cl2在高温下反应,该反应中C和Cl2按质量比为12:71的比例参加反应,相应的化学方程式为 。
(3)反应②的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体。则该反应的化学方程式为 。
工业上用闪锌矿(主要含ZnS,还有PbS等杂质)制备Zn,并将产生的废气转换成工业原料,设计流程如图(部分产物略去)。

(1)X的化学式 ,图中用过量空气的目的是 ;
(2)①~ ④中属于化合反应的是 ;
(3)Zn (填“能”或“不能”)与氯化铅(PbCl2)溶液反应;
(4)写出③中生成ZnO的化学方程式 ,产生的工业废气SO2在一定条件下与氧气化合生成的Z物质是 (填化学式)。
我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热到约800℃,得到黄铜(铜锌合金,外观似黄金),其流程如下:
请回答下列问题:
(1)赤铜矿中铜元素的化合价为 ;
(2)区分黄铜与黄金,可用酒精灯灼烧,若看到 ,则是黄铜;若表面无现象,则是黄金;
(3)气体A中除CO2外,还有一种气体是 (填化学式);
(4)加热时,发生反应的化学方程式有:①ZnCO3═ZnO+CO2↑
②C+2ZnO═2Zn+CO2↑ ③ ;(木炭粉与赤铜的反应)
已知化学反应中,物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫做还原反应。在反应②中,ZnO发生 (填“氧化”或“还原”)反应;

工业上生产纯碱的部分工艺如下:

反应原理是①NaCl+H2O+NH3+CO2═NH4Cl+NaHCO3↓
②2NaHCO3 Na2CO3+H2O+CO2↑
某兴趣小组设计了如下装置在实验室模拟该制碱过程,分析并回答问题。

(1)装置C中发生反应的化学方程式是 。
(2)B中导气管的作用是 。
(3)反应原理②的实验可在 (填字母)装置中进行。
(4)反应过程中的副产品NH4Cl是农业上常用的 (填肥料种类)。
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd(钯,银白色)。如图是某工厂回收其中部分金属的流程图。(假设流程图中各反应均恰好完全反应。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
2CuSO4+2H2O)
(1)步骤②中产生的气体是 。
(2)滤渣2中含有的金属是 。
(3)步骤⑤反应的化学方程式 。
(4)步骤⑥回收的纯净物B是 (写化学式)。
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是 。

某化工厂按如下步骤进行生产:
(1)以煤为燃料煅烧石灰石;(2)用饱和Na2CO3溶液充分吸收(1)中产生的CO2气体(Na2CO3+CO2+H2O=2NaHCO3;(3)使(1)中产生的CaO与水反应;(4)熟石灰与碳酸钠溶液反应.该厂生产过程中所涉及的物质有①石灰石;②碳酸钠;③碳酸氢钠;④烧碱;⑤二氧化碳;⑥熟石灰( )
A.起始原料是①③B.起始原料是②⑥
C.最终产品是⑤⑥D.最终产品是③④
CO2是重要的资源,以其为原料可获得下列四种物质。下列说法错误的是( )
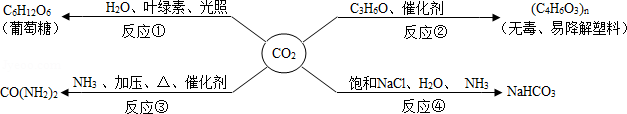
A.反应①是太阳能转化为化学能
B.反应②的实现有利于缓解“白色污染”
C.反应③可用来制取氮肥
D.反应④获得产品后的剩余液中,溶质只有NaHCO3
氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示:

参考资料:SiO2既不溶于水也不与酸反应
(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为 ;
(2)残渣中除金属锌外,还有 ;
(3)操作一、操作二和操作三采用的分离方法是 ;
(4)操作四发生反应的化学方程式为 。
海洋中蕴含丰富的资源。
(1)海水淡化是解决淡水资源不足的重要方法,下列方法中,可以使海水淡化的是 (填字母序号);
A.滤纸过滤 B.吸附 C.沉降 D.蒸馏
(2)从海水中提炼出来的重水(D2O)可作原子能反应堆中的减速剂和传热介质,重水中重氢原子(D)的相对原子质量是2,则重水中氧元素的质量分数为 ;
(3)利用海水制取纯碱和金属镁的流程如图所示,试回答问题:

①1925年我国化学家 创立了联合制碱法,促进了世界制碱技术的发展,其第Ⅲ步反应的化学方程式为 ;
②步骤Ⅴ中所加试剂是 。
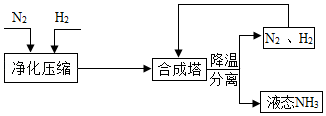
工业上合成 NH 3 的工艺流程可简化为:
(1)工业上制取 N2 时所用的廉价、易得的原料是 ;
(2)用焦炭和水蒸气制取氢气的反应过程为:C+H2O CO+H2,CO+H2O CO2+H2
其中发生还原反应的物质是 ;
(3)在高温、高压、催化剂存在的条件下,生成 NH3的化学方程式为 ;
(4)将降温分离出的 N 2、H 2 送回合成塔的目的是 ;
A. 充分利用原料 B. 防止氮气污染空气.
目前,农业上使用最多的氮肥主要有尿素、硝酸铵和碳酸氢铵等,其中硝酸铵的生产原理是利用氨催化氧化得到的硝酸,再跟氨反应生产硝酸铵,基本流程如下:

已知:①上述流程图中A、B、C均为气体,其中A、B为单质且A的相对分子质量为28,C为含有A组成元素的化合物;氨与氧气反应的条件是高温、催化剂。
②在化学反应中,只要有物质所含元素的化合价发生了变化的反应就是氧化还原反应。例如:2Na+2H 2O═2NaOH+H 2↑,反应前后,Na元素、H元素的化合价分别发生了变化,该反应是氧化还原反应。
请回答下列问题:
(1)写出A、C两种物质的化学式:A为 ;C为 。
(2)NH 3和O 2反应的化学方程式为
(3)上述流程图的5个反应中有 个属于氧化还原反应。
试题篮
()