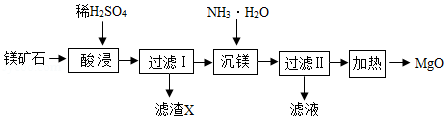
以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如图

注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为 (填化学式)。
(2)实验室中用图一所示装置进行过滤。
①该装置中仪器A的名称为 。
②若过滤时滤液出现浑浊,可能的原因是 (填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3•H2O发生反应。结合图二,写出该反应的化学方程式 。
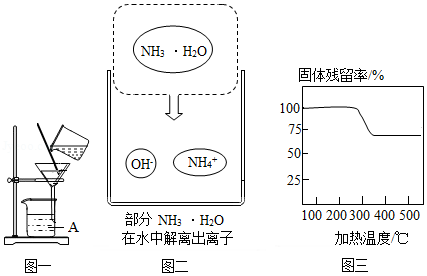
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如题图三所示。“加热”时温度至少要达到350℃,原因是 。
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.H2O2 O2 SO2
B.Cu Ag AgCl
C.酒精 CO2 CO
D.钢铁 Fe2O3•xH2O FeSO4
以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如图
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为 (填化学式)。
(2)实验室中用图一所示装置进行过滤。
①该装置中仪器A的名称为 。
②若过滤时滤液出现浑浊,可能的原因是 (填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3•H2O发生反应。结合图二,写出该反应的化学方程式 。
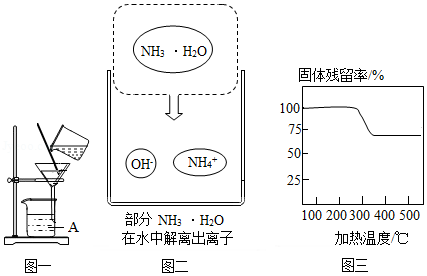
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如题图三所示。“加热”时温度至少要达到350℃,原因是 。
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.H2O2 O2 SO2
B.Cu Ag AgCl
C.酒精 CO2 CO
D.钢铁 Fe2O3•xH2O FeSO4
胆矾(CuSO4•5H2O)在工农业生产中有广泛的用途。实验室利用废旧电池的铜帽(主要含铜和锌)为原料制备胆矾。实验流程如图所示:
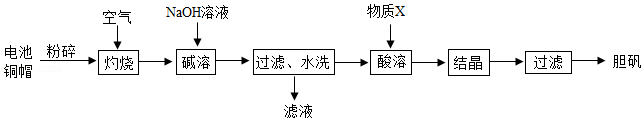
查阅资料:氧化锌能溶于氢氧化钠溶液。
(1)废旧电池铜帽的表面常有油污,可用洗洁精预先除去,洗洁精在除去油污的过程中起 作用。
(2)“碱溶”步骤中,为加快反应速率可采取多种措施,如搅拌、 等。
(3)“酸溶”时,发生反应的化学方程式是 。
(4)“灼烧”完全(已充分反应)的判断依据是 。
我国煤炭资源丰富,目前人们除了将煤作为燃料外,更是重要的化工原料。工业上以煤和空气为原料生产尿素[CO(NH2)2]的一种流程如图:
(1)从液态空气中分离出N2的过程属于 (填“物理”或“化学”)变化。
(2)在煤和水蒸气反应前需先将煤粉碎,这样做的目的是 。
(3)水煤气在铜催化下实现CO的转化:CO+H2O CO2+X,其中X的化学式为 。
(4)上述流程中合成尿素的同时还有水生成,该反应的化学方程式为 。
(5)实际生产中,N2和H2不可能全部化为NH3.上述流程中可以循环利用的物质有 。
(6)以CO2和H2为原料还可合成液体燃料乙醇(C2H6O),该过程可用化学方程式表示为:
2CO2+6H2 C2H6O+3H2O.已知:每克燃料完全燃烧数出的热量叫做热值
物质 |
煤 |
乙醇 |
热值/kJ•g﹣1 |
约33 |
30 |
若将含12g碳的煤为原料合成的乙醇完全燃烧,理论上最多可放出 kJ的热量,从而提高了煤的利用效率。
在一定条件下,下列物质间的转化不能一步实现的是( )
A.Fe→Fe3O4B.Zn→ZnCl2C.H2CO3→CO D.NH4NO3→NH3
教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
Ⅰ.活动探究
(1)学会识图分拣垃圾:下列垃圾应投入带有如图图标的垃圾箱内的是 (填字母序号)。
| A. |
塑料瓶 |
| B. |
果皮 |
| C. |
碎瓷片 |
(2)学会检验有害气体:含氯塑料焚烧时会产生氯化氢等气体。若要检验焚烧后的气体中有氯化氢,可将其通入 溶液中,有白色沉淀生成即可。
Ⅱ.实验探究:
[提出问题]如何回收处理废旧电池中的镉?
[查阅资料]
(1)废旧电池中含有镉、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体。在化合物中通常表现为+2价。
(3)碳酸镉(CdCO 3)、氢氧化镉[Cd(OH) 2]都是白色固体、难溶于水。
[设计实验]先将废旧电池进行处理以制得硫酸镉( CdSO 4)溶液,用于以下实验。
| 实验设计 |
实验步骤 |
实验现象 |
实验结论 |
| 与金属反应 |
取少许溶液于试管中,加入足量的Zn粉,充分反应。 |
|
Zn可以置换出Cd |
| 与碱反应 |
取少许溶液于试管中,加入足量的NaOH溶液,充分反应。 |
产生白色沉淀 |
用化学方程式表示为 。 |
| 与盐反应 |
取少许溶液于试管中,加入足量的 溶液,充分反应。 |
产生白色沉淀 |
可用该试剂除去CdSO 4. |
[回收处理]
实验结束后,将反应后的混合物通过过滤、洗涤、加热,进而再制得镉。
[交流反思]
请同学们基于化学视角说明垃圾分类回收处理的重要意义 (答一点即可)。

无水氯化钙的用途广泛。以石灰石矿粉(含有MgSO4、Fe2O3、SiO2等杂质)为原料,生产无水氯化钙的流程如图:
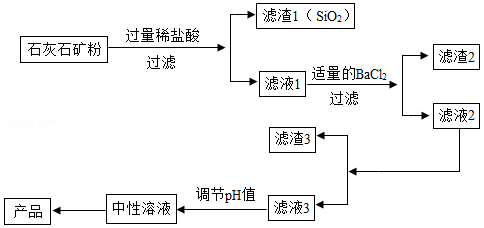
(1)写出过滤操作中用到的任意一种玻璃仪器的名称 ;
(2)写出滤液1中含有的所有金属阳离子的符号 ;
(3)滤渣3中的固体除有Ca(OH)2外,还有 (写化学式);
(4)对滤液3调节pH值时发生反应的化学方程式为 。
下列各组物质,不能按照关系图(“→”表示反应一步完成)相互转化的是( )
选项 |
物质 |
||
x |
y |
z |
|
A |
Mg(NO3)2 |
Mg(OH)2 |
MgSO4 |
B |
K2SO4 |
KCl |
KNO3 |
C |
BaCl2 |
Ba(NO3)2 |
BaCO3 |
D |
CaO |
CaCl2 |
CaCO3 |

A.AB.BC.CD.D
下列各组物质,不能按照关系图(“→”表示反应一步完成)相互转化的是( )
选项 |
物质 |
||
x |
y |
z |
|
A |
Mg(NO3)2 |
Mg(OH)2 |
MgSO4 |
B |
K2SO4 |
KCl |
KNO3 |
C |
BaCl2 |
Ba(NO3)2 |
BaCO3 |
D |
CaO |
CaCl2 |
CaCO3 |
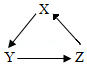
A.AB.BC.CD.D
下列各组物质,不能按照关系图(“→”表示反应一步完成)相互转化的是( )
选项 |
物质 |
||
x |
y |
z |
|
A |
Mg(NO3)2 |
Mg(OH)2 |
MgSO4 |
B |
K2SO4 |
KCl |
KNO3 |
C |
BaCl2 |
Ba(NO3)2 |
BaCO3 |
D |
CaO |
CaCl2 |
CaCO3 |
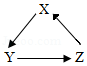
A.AB.BC.CD.D
氯碱工业以粗盐(主要成分是NaCl,含少量泥沙、CaCl 2、MgCl 2)为原料,生产氯气和氢氧化钠,模拟流程如图: 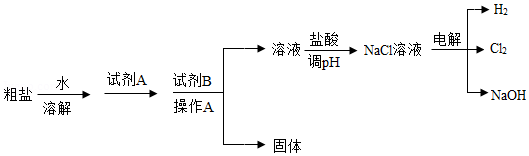
(1)试剂A与试剂B的组合为 (填序号)
①KOH ②NaOH ③K 2CO 3 ④Na 2CO 3
(2)操作A需使用玻璃棒,玻璃棒的作用是 。
(3)流程中Mg元素必须转化成 (填化学式)才能完全除去。
(4)写出电解NaCl溶液的化学方程式 。
(5)该工业副产品H 2目前还不能作为燃料被广泛应用,其理由 (答一条即可)。
甲、乙、丙、丁都是含碳的物质,它们有如下关系:①甲与丙在高温的条件下反应生成乙;②乙与氧气在点燃的条件下反应生成丙;③常温下丁能分解生成丙。则甲、乙、丙、丁分别是( )
A.C、CO、CO2、CaCO3B.C、CO、CO2、H2CO3
C.CO、C、CO2、CaCO3D.CO2、C、CO、H2CO3
海洋是人类宝贵的自然资源,海水“制盐”体现了人类利用化学科学征服和改造自然的智慧。通过晾晒海水,可以得到粗盐,粗盐中含有不溶性杂质(如泥沙等)和可溶性杂质(如MgCl2、CaC12等),工业上以粗盐为原料制取精盐,其生产流程如图所示
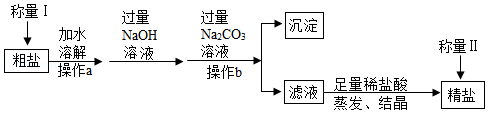
请回答下列问题:
(1)操作b中玻璃棒的作用是 。
(2)加入Na2CO3溶液除去的离子是 (填离子符号),加入NaOH溶液发生反应的化学方程式为 ;
(3)滤液中溶质的主要成分是 (填化学式),加入足量稀盐酸的目的是 。
(4)如果称量Ⅰ中称得粗盐的质量为3g,称量Ⅱ中称得精盐的质量为3.1g,则下列分析正确的是 (填字母)
A.精盐的产率为103.3%
B.蒸发操作中可能有水分没有蒸干
C.除杂过程中有NaCl生成
D.溶解操作中粗盐没有完全溶解
试题篮
()