铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为 。
(2)铁锈主要成分是Fe 2O 3•nH 2O,铁生锈主要与空气中的 有关。
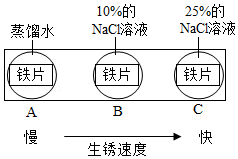
(3)如图实验说明NaCl在铁生锈中的作用是 。
(4)铁生锈的次要过程:Fe 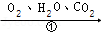 FeCO 3•nH 2O
FeCO 3•nH 2O  FeCO 3
FeCO 3
写出Fe转化为总反应的化学方程式 。
(5)为防止铁生锈,可对铁制品进行"发蓝"处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为 。
(二)废铁的再利用
黄钠铁矾[NaFe x(SO 4) y(OH) z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe 2O 3和FeCO 3)制备黄钠铁矾的主要流程如图:
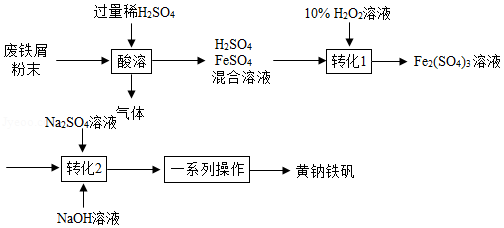
(1)将废铁屑研磨成粉末的目的是 。
(2)"酸溶"时H 2SO 4与Fe、FeCO 3反应,还发生反应的化学方程式有 和Fe+Fe 2(SO 4) 3=3FeSO 4。
(3)"转化1"发生反应的化学方程式为 。反应时温度不宜过高的原因是 。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用如图装置进行热分解实验。
【资料】
①NaFe x(SO 4) y(OH) z在T 1℃分解会生成H 2O(气态),提高温度至T 2℃继续分解产生SO 3气体,并得到Fe 2O 3和Na 2SO 4。
②浓硫酸可用于吸收SO 3。
(1)装配好实验装置后,先要 。
(2)分别控制温度在T 1℃、T 2℃对A中固体加热。
①控制温度在T 1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T 2℃,加热至反应完全。
③T 1℃、T 2℃时,加热后均通入一段时间N 2,目的是 。
(3)反应完全后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFe x(SO 4) y(OH) z中,x:y:z= 。
反思:若该实验过程中缺少C装置,则x:z的值 (选填"偏大""偏小"或"不变")。
试题篮
()