将1.1g某钢样在纯氧中完全燃烧,得到0.0121g二氧化碳,则此钢样中碳的质量分数为( )
| A. 1.3% | B. O.3% | C. 3% | D. 1.21% |
为测定某盐酸溶液中氢元素的质量分数。世博同学向一定质量的石灰石中加入 105.4g稀盐酸,充分反应后,得到溶质质量分数为10%的111g溶液,则稀盐酸中氢元素的质量分数为( )
| A. 10.5% | B. 0.2% | C. 5.1% | D. 15% |
有一种含碳酸钙、氢氧化钙和氧化钙的混合物,测得其中钙元素质量分数为50%,取该混合物16g,向其中加入一定量7.3%的稀盐酸,恰好完全反应后,所得溶液中溶质的质量为( )
| A.11.1g | B.22.2g | C.14.8g | D.20g |
现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g,则瓶内过氧化氢溶液中溶质的质量分数为( )
A.3% B.6.8% C10% D.20%
用一定量的稀硫酸与20g的8%氢氧化钠溶液恰好完全反应。如果把这种氢氧化钠换成11.2%的氢氧化钾,那么恰好反应时,用去氢氧化钾溶液的质量为( )
| A.22.4g | B.20g | C.11.2g | D.56g |
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 反应后固体的质量m∕g |
80 |
75 |
70 |
66 |
62 |
58 |
58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
(3)请在下面坐标图中,画出煅烧时生成气体的质量(m)随时间(t)变化的曲线。
鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15 g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80 g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半。试计算(计算结果保留1位小数):
(1)产生CO2的质量为__________ g;
(2)该鸡蛋壳中CaCO3的质量分数。
(3)所用稀盐酸中溶质的质量分数。 
钱江晚报报道舟山“碘过量":有舟山市民说,一位原本很帅气的舟山小伙子,因患甲状腺疾病,眼球突出,脖子粗大,身体消瘦。因此呼吁 大家再也不能吃加碘盐了。舟山的医学研究人员发现近年来甲状腺疾病患者明显增多,因此开展了“舟山海岛地区城镇居民甲状腺肿瘤流行病学调查”,提出“浙江沿海地区食盐中是否有必要加碘值得关注”。

(1)如图甲是上述调查得到的图表之一,此图表能够反映出的信息是
;
A.该地区居民中患甲状腺瘤的男性人数是女性的一半
B.该地区女性居民更容易患甲状腺疾病
C.该地区居民中甲状腺疾病患者明显增多
D.该地区居民比其他地区居民更容易患甲状腺疾病
(2)“碘是智慧元素”,它是合成甲状腺激素的重要原料之一,若人在幼年时期甲状腺激素分泌不足,可能会患 。我国大部分地区缺碘,早在上世纪90年代就颁布了《食盐加碘消除碘缺乏危害管理条例》,食盐加碘成为一项国家政策;
(3)“加碘盐”,一般是在食盐中加入一定量的碘酸钾(KI03),碘酸钾属于 ;
A.混合物 B.化合物 C.氧化物 D.单质
(4)如图乙为某品牌食盐的产品说明,其中“含碘量(35±15)mg/kg”表示在每千克“加碘盐"中含碘元素(35±15)毫克,符合国家食盐含碘量的标准。
以含碘量35毫克/千克为标准,食盐厂家应该在1千克食盐中加人多少毫克碘酸钾?
(5)“碘是一把双刃剑”,碘过量也会引起甲状腺疾病。初中生每天碘元素适宜摄人量约为0.15毫克,假设碘元素全部来自“加碘盐”,你一天最多可以摄入含碘量为35毫克/千克的食盐多少克?
(6)人体所需碘元素并非全部来自“加碘盐",人们可以从饮用水、粮食、蔬菜和周围环境中摄取碘元素,如图丙为部分海产品含碘量。请根据报道内容及以上的分析计算结果,并参考图丙,针对舟山“碘过量”现象,为舟山市民提一条建议。
在一硬质玻璃管中盛放着8g Fe2O3,通入CO气体高温加热一段时间,冷却后,测得玻璃管内的固体的质量减少了1.2g,则此时玻璃管内固体物质中铁元素的质量为下列的
| A.6.8g | B.5.6g | C.2.8g | D.1.2g |
我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗34.7g,放出的气体在常温下体积为1.1L。
(1)常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 g。
(2)如石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数)。
在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示。下列未知数据计算正确的是()
| A. | ①为7 | B. | ②为5 | C. | ③为3.75 | D. | ④为16.25 |
密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
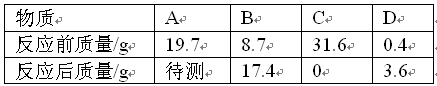
已知A与C的相对分子质量之比为197∶158,下列推理正确的是( )。
| A. | C一定是化合物,D可能是单质 |
| B. | 反应过程中,B与D变化的质量比为87∶36 |
| C. | 反应后密闭容器中A的质量为19.7 |
| D. | 反应中A与C的化学计量数之比为1∶2 |
在一密闭容器内有
、
、
、
四种物质,在一定条件下充分反应,反应前后各物质质量如右表,则下列说法正确的是
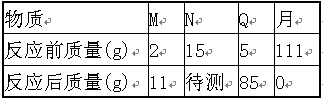
| A. | 该反应属于化合反应 |
| B. | 待测物质 的质量为22g |
| C. | 该反应属于分解反应 |
| D. | 反应中 、 、 、 四种物质质量比为9:37:80:111 |
将一定质量的
、
、
、
四种物质放 入一密闭容器中,在一定条件下反应一段时间后,测得
入一密闭容器中,在一定条件下反应一段时间后,测得 各物质的质量如下:
各物质的质量如下:
| 物质 |
||||
| 反应前的质量/g |
6.4 |
3.2 |
4.0 |
2.5 |
| 反应后的质量/g |
3.8 |
待测数据 |
7.2 |
2.5 |
下列说法错误的是
| A. |
和 是反应物, 可能是催化剂 |
| B. |
上表中的"待测数据"的数值为0.6 |
| C. |
物质中元素的种类,一 |
| D. |
该反应一定属于化合反应 |
在一个密闭容器内有4种物质,在一定条件下充分反应,测得反应前后各物质的质量,数据见下表。
| 物 质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/ | 12 | 10 | 30 | 5 |
| 反应后质量/ | 待测 | 19 | 待测 | 16 |
下列说法正确的是
| A. | 无论甲、丙的待测值为多少,甲、丙一定都是反应物 |
| B. | 如果丙的待测值为0,则只有乙、丁是生成物 |
| C. | 如果丙的待测值为10,则该反应为分解反应 |
| D. | 如果甲的待测值为0,则参加反应的甲、丙的质量比为 |
试题篮
()