镁是一种活泼性较强的金属,在空气中易发生缓慢氧化,表面呈灰黑色。
(1)镁与氧气的反应属于(填基本反应类型)。要观察金属镁的颜色,需将镁条如何处理。
(2)若30
镁条存放一段时间后,质量变为了34
,则参加反应的氧气为
(假设镁只与氧气反应)。若将上述氧化前和氧化后的镁条分别与足量稀硫酸反应,生成硫酸镁的质量关系是前者后者(填">"、"="或"<")。
(3)将2.4
未氧化的镁加入到97.8
的稀硫酸中,恰好完全反应。求反应后所得溶液的溶质质量分数(假设反应过程中水分未损失)。
小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯化钠组成的产品中氯化钠的质量数。取16.25g固体样品,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。技术员给小红的提示:反应的化学方程式BaCl2+Na2CO3=BaCO3↓+2NaCl

(1)当氯化钡与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是———g。
(2)产品中氯化钠的质量分数是多少?
(3)当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
为了测定碳酸钠样品(内含有氯化钠)的纯度,现将10克样品加入重为5克的烧杯中,再往烧杯中加入40克水搅拌至固体完全溶解,再向烧杯中加入50克稀盐酸,恰好不再产生气泡,称得烧杯总质量为102.8克。
请完成下列计算:
(1)反应产生的气体的质量是多少?
(2)碳酸钠样品中碳酸钠的质量分数是多少?
(3)盐酸溶液中溶质的质量分数是多少?
(6分)某学校化学兴趣小组的同学想测定赤铁矿中氧化铁的含量,做了如下实验:首先称取100 g该赤铁矿样品放入烧杯中,然后将500g的稀盐酸分5次加入烧杯内(假设其余杂质均不与盐酸反应也不溶于水)进行充分反应。实验过程中的数据记录如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 稀盐酸的质量 |
100g |
100g |
100g |
100g |
100g |
| 溶液的质量 |
116.0g |
X |
348.0g |
464.0g |
575.0g |
请回答下列问题:
(1)该小组要用质量分数为36.5%浓盐酸配制所需的500g的稀盐酸,则需浓盐酸的质量为_____
(2)写出实验中发生反应的化学方程式 ____________________
(3)列出求解生成氯化铁总质量的比例式 ____________________
(4)将第二次反应后所得溶液蒸发掉32g水(未达到饱和),则所得溶液的溶质质量分数是________
(5)某工厂要想制得420t含杂质3%的生铁,需要这种赤铁矿的质量为 ___________
请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),完成下列问题:

(1)该反应产生的
气体质量为g。
(2)计算反应后所得溶液中溶质质量分数(写出计算过程)
“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如下:
请回答下列问题:
(1)H2O2在催化或受热条件下易分解,说明化学变化的速度和 相关;
(2)在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是 (填序号)。
| A.二氧化锰 |
B.稀盐酸 |
C.硫酸钠 |
D.石灰水 |
(3)“过碳酸钠”极易分解,得到碳酸钠、水和氧气,其反应方程式可表示为
2(2Na2CO3.3H2O2)==4Na2CO3+6H2O+3O2↑
请通过计算说明(必须有计算的过程):
①若“过碳酸钠”分解产生氧气12g,则同时产生碳酸钠的质量是多少?
②若将上述产生的碳酸钠全部配制成溶质质量分数为10.6%的溶液,共需水多少毫升?
今年我国“世界环境日”的主题是向污染宣战,某化工厂排放的废水中含有碳酸钠,提取50g废水样品于集气瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,收集到4.4g二氧化碳,请回答问题:
(1)判断滴加硫酸至恰好反应的依据是 。
(2)所消耗的稀硫酸质量是多少?
(3)最后所得溶液中溶质的质量分数是多少?(本小题最后结果取整数)
用 溶液测定某种氮肥中 的质量分数(杂质溶于水,但不参加反应).
实验如下:称取该氮肥20
加水完全溶解,向该溶液中不断滴入
溶液,生成气体及沉淀质量与加入
溶液的质量关系如下所示:

| 实验次序 |
1 |
2 |
3 |
| 滴入 溶液的质量 | 20 |
40 |
60 |
| 生成气体的质量 | 0.85 |
2.55 |
试分析并计算:【已知:
】
(1)表格中
的值为
.
(2)实验所用氢氧化钡溶液中溶质的质量分数.
(3)该氮肥中 的质量分数.(计算结果精确至0.1 )
Na2CO3中往往会含有少量的NaCl,现在一烧杯中盛有20.4g的固体混合物,向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题: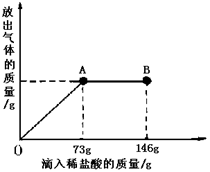
①当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填>、=、<)。
②当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
在一烧杯中盛有60.2gBaCO3和BaCl2的粉末状混合物,向其中加入188.8g水使混合物中可溶物完全溶解,然后向其中逐滴加入溶质质量分数为10%的稀盐酸至146g时恰好反应完全,请根据题意回答问题:
(1)在滴加盐酸过程中观察到的明显实验现象是 。
(2)当盐酸滴加至140g时,烧杯中溶液里含有溶质的是 。(写化学式)
(3)计算恰好反应完全时烧杯中所得不饱和溶液的质量。(结果精确到0.1g)
小芳在实验室用石灰石和稀盐酸制取了二氧化碳,并对实验产生的废液进行溶质成分鉴定:取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,洗涤,干燥,称得沉淀质量为5克,并绘制了图象,如图:
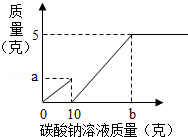
(1)图象中的a点数值
(2)废液中含有的溶质是 (写化学式)
(3)通过计算说明,图象横坐标中b点表示的溶液的质量是多少?
某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓

(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为 g.
(2)计算MgSO4溶液中溶质的质量分数(列式计算).
黄铜是一种常见的合金材料,其作用成分为
、
,还含有少量不与酸反应的成分.现向一定质量的黄铜中加入体积为100mL,密度ρ=1.2g/mL的稀硫酸,产生
的质量和硫酸溶液体积的关系如图所示.充分反应后溶液中剩余固体的质量为27g。

(1)观察图象,黄铜与硫酸充分反应后,硫酸是否有剩余?(选填"是"或"否")
(2)黄铜中
的质量分数为多少?(请列式计算,结果精确到0.1%)
(3)若往反应后的溶液中滴加26%的
溶液至恰好不再产生沉淀时,共消耗
溶液400g,则原硫酸溶液的质量分数为多少?(请列式计算,结果精确到0.1%)
某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成
溶液,将其全部加入到
一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是
,将溶液蒸干,得到
硫酸钠。
计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中碳酸钠的质量分数(计算结果精确到0.1%)。
酸和碱发生中和反应,它在日常生活和农业生产中有着广泛的应用。小强同学在做中和反应实验时,向盛有40克10%氢氧化钠溶液的烧杯中逐滴加入稀硫酸,滴加过程如图所示,求所加稀硫酸的溶质质量分数。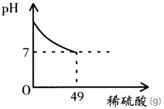
试题篮
()