为测定某
溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定。现取待测液50.0 g,滴定过程如图所示。
(滴定反应为:
,
的相对原子质量为108,计算结果均保留1位小数)

(1)
的相对分子质量为:;
(2)计算
溶液的溶质质量分数:;
(3)计算恰好完全反应时,所得溶液的溶质质量分数:。
将Na2CO3和NaCl固体混合物22.3 g放入烧杯中,加入182.1 g稀盐酸恰好完全反应。待没有气泡逸出后,称量烧杯中剩余物质总质量为200 g。请计算:
(1)生成二氧化碳的质量是_ __;
(2)所得溶液中溶质的质量分数是多少?
某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示。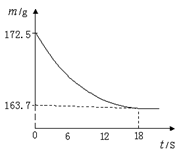
求:(1)计算碳酸钠中各元素的质量比:Na:C:O= 。
(2)碳酸钠的相对分子质量为: 。
(3)生成CO2的质量。
(4)该纯碱样品中Na2CO3的质量分数。
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g。某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g。
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线。
已知硫酸钾,氯化钾的水溶液都呈中性,根据下图所示的信息计算:
(1)加入的稀硫酸溶液的质量为 克。
(2)反应后所得溶液的溶质质量分数。
(3)拓展:若用等质量等质量分数的盐酸代替稀硫酸,充分反应后测定溶液的酸碱度,你认为pH 7(填>或=或<),理由是 。
过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶质的质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行实验。测得相关数据如下图所示:
(1)剩余的混合物中二氧化锰的质量为__________g
(2)反应生成氧气的质量为 g
(3)计算该过氧化氢溶液中溶质的质量分数。(写出计算过程)
某化学兴趣小组的同学采集了一些大理石样品,为测定该样品中碳酸钙的质量分数,取样品6g粉碎成粉末状置于烧杯中,向其中加入10%的稀盐酸并不断搅拌,恰好不再有气泡产生时(已知杂质不与稀盐酸反应),共用去稀盐酸36.5g。
(1)计算样品中碳酸钙的质量分数。
(2)计算反应后所得溶液中溶质的质量分数?(结果保留到0.1%)
马英同学取某地石灰石样品
进行测定实验,现将
稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
| 第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
| 加入稀盐酸的质量 | |||||
| 生成气体的总质量
|
试求:
(1)
的值为
(2) 石灰石样品中碳酸钙的质量等于
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1)
实验室常用石灰石和稀盐酸制取二氧化碳,现取含碳酸钙80%的石灰石12.5
和94.4
稀盐酸恰好完全反应(石灰石中的杂质不溶于水,也不与稀盐酸反应)。求:
(1)生成二氧化碳的质量;
(2)恰好完全反应后所得溶液中溶质的质量分数。
如图是某胃药标签的部分内容。小明同学测定该药品中
含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成
的不饱和溶液,共消耗稀盐酸11.5克。称得反应后烧杯内物质的总质量为64.3克。

请计算:(1)反应完成后生成气体的质量为g。
(2)反应后烧杯中溶液的质量和胃药中
的质量分数。
某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品
,把
稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:

(1)表中
的数值为。
(2)样品中碳酸钙的质量分数是。
(3)求盐酸中溶质的质量分数。
某腐蚀印刷电路板的废液中含有
和
,为了分析该废液的组成,取1 000 g废液,设计如下实验方案进行探究:
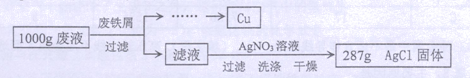
实验过程中加入废铁屑的质量、析出
的质量的数据记录如下表:
| 废铁屑的质量/g |
20 |
40 |
60 |
80 |
| 析出
的质量/g |
12.8 |
25.6 |
32 |
32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1000 g废液与足量废铁屑完全反应,析出
的质量为。
(2)废铁屑中单质Fe的质量分数为。
(3)计算1000 g废液中
的质量分数。(写出计算过程,结果保留小数点后一位)
(4)1000 g废液中
的质量分数为。(结果保留小数点后一位)
胃酸主要成分是盐酸,正常人胃液每日需要盐酸溶质质量约为
.某患者每日分泌盐酸溶质质量为9.0
,为治疗胃酸过多需服用图9所示抑酸剂,发生反应:
.请计算并回答:按说明书用法用量,每天最多可中和胃液中盐酸溶质质量是多少克?理论上能否使该患者胃液中盐酸溶质质量恢复到正常范围?(写出计算过程,结果精确到0.001)

某纯碱样品中含有少量
,小丽同学取该样品23
全部溶解于150
水中,再逐滴加入160
稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。(提示:相关反应为
)计算当恰好完全反应时:
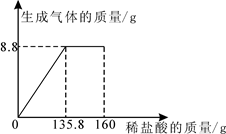
(1)产生的二氧化碳的质量是克。
(2)此时所得到的溶液中溶质的质量分数(写出必要的计算过程,结果保留到0.1
)。
一定质量的氯化钡溶液和10g溶质质量分数为9.8%的稀硫酸恰好完全反应后,过滤得到28.47g滤液。请计算:
(1)生成硫酸钡沉淀的质量;
(2)氯化钡溶液的溶质质量分数。
试题篮
()