某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
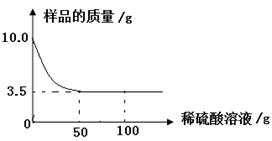
(1)铜锌合金汇中,
的质量分数是.
(2)所用稀硫酸溶液中溶质的质量分数是多少?
用 溶液测定某种氮肥中 的质量分数(杂质溶于水,但不参加反应).
实验如下:称取该氮肥20
加水完全溶解,向该溶液中不断滴入
溶液,生成气体及沉淀质量与加入
溶液的质量关系如下所示:

| 实验次序 |
1 |
2 |
3 |
| 滴入 溶液的质量 | 20 |
40 |
60 |
| 生成气体的质量 | 0.85 |
2.55 |
试分析并计算:【已知:
】
(1)表格中
的值为
.
(2)实验所用氢氧化钡溶液中溶质的质量分数.
(3)该氮肥中 的质量分数.(计算结果精确至0.1 )
某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓

(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为 g.
(2)计算MgSO4溶液中溶质的质量分数(列式计算).
小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯化钠组成的产品中氯化钠的质量数。取16.25g固体样品,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。技术员给小红的提示:反应的化学方程式BaCl2+Na2CO3=BaCO3↓+2NaCl

(1)当氯化钡与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是———g。
(2)产品中氯化钠的质量分数是多少?
(3)当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
为测定某石灰石样品中碳酸钙的含量,取10g石灰石样品,研碎加入烧杯中,将80g稀 盐酸分四次加入烧杯中。每次加入稀盐酸,充分反应后测定反应生成气体的总质量(与前面实验中产生的气体累加),数据记录如下表:(杂质不参加反应,不含钙元素.第二问要求作答)
| 序号 |
1 |
2 |
3 |
4 |
| 加入稀盐酸的质量(g) |
20 |
20 |
20 |
20 |
| 充分反应产生气体的总质量(g) |
1.1 |
n |
3.3 |
3.3 |
| 实验的次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 所加盐酸的质量/g |
20 |
20 |
20 |
20 |
| 产生气体的质量/g |
1.1 |
n |
3.3 |
3.3 |
(1)表中n的值为 。
(2)计算石灰石样品中碳酸钙的质量分数。
(3)第4次加入稀盐酸后,烧杯中钙元素的质量为 g
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,向其中加入57.9g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:
(1)小明要从反应后的溶液中提取NaCl应采用的方法是 ;
(2)纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
(3)反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程)
某补钙剂说明书的部分信息如下左图所示。现取40片该药剂制成粉末,将100g盐酸分成5等份逐次入(其他成分不与盐酸反应),所得数据如下右图所示。计算:该补钙剂中钙元素的质量分数.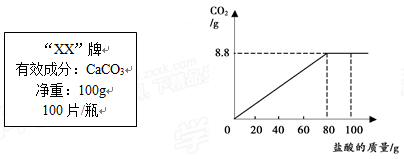
实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。试回答: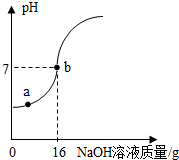
(1)a点溶液中含有的离子有 。
(2)计算稀H2SO4的溶质质量分数。
某溶液中可能含有碳酸钠、氯化钾、硫酸钠、硫酸中的一种或几种,为测定其组成,进行如下实验:
取样20g,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的质量与时间的关系如图所示.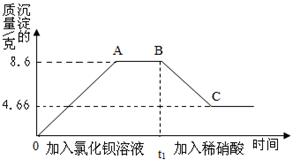
(1)实验中,AB之间图象所对应的溶液中的溶质一定有 .
(2)BC段沉淀减少的原因是 (用化学方程式表示).
(3)由上述实验可知,原溶液中一定含有 ,可能有 .
(4)求原溶液中硫酸钠的质量分数。
(10分)市售珍珠粉的价格相差很大,但其外观、手感都没有明显差异,优质珍珠粉和廉价珍珠粉的成分有何不同呢?实验小组同学展开探究。
【查找资料】
①优质珍珠粉直接由贝科动物体内珍珠加工而成,含有一定量的氨基酸、碳酸钙等。
②廉价珍珠粉由“贝壳粉”加工而成,贝壳加工过程中会用到氢氧化钠,贝壳的主要成分是碳酸钙。
③珍珠粉中除碳酸钙外,其它成分均不能与盐酸反应生成二氧化碳。
④氨基酸大部分能溶解于水,遇到浓硝酸并加热会呈现黄色或黑色。
⑤碳酸钙与浓硝酸能发生反应,生成二氧化碳。
⑥氯化钙溶液呈中性。
【提出猜想】优质珍珠粉和廉价珍珠粉的区别可能在于:
①廉价珍珠粉含有 ;
②廉价珍珠粉不含氨基酸;
③碳酸钙含量不同。
【实验探究】
| 实 验 内 容 |
现 象 |
结 论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 。 |
廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 |
猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,过滤, ,加热。 |
优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 |
猜想 成立 |
(3)分别将一定质量的优质珍珠粉和廉价珍珠粉放入烧杯中,再逐滴加入14.6%的稀盐酸,边滴加边振荡,直至恰好完全反应。数据记录如下:
| |
优质珍珠粉 |
廉价珍珠粉 |
| 珍珠粉的质量 |
100g |
100g |
| 加入盐酸的质量 |
460.0g |
500g |
| 烧杯中最终物质的总质量 |
520.0g |
558.2g |
①处理数据时,小明提出了如下思路:用加入盐酸的质量乘以盐酸的质量分数,求出反应的盐酸中的溶质质量,进而利用化学方程式 (填写反应方程式)求出珍珠粉中碳酸钙的质量。
你认为小明的思路是否可行? (填“可行”或“不可行”)理由是 。
②处理数据后,得出结论:廉价珍珠粉中碳酸钙的质量分数为 %,含量高于优质珍珠粉。
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品11.2g,向其中加入93.2 g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:(结果精确到0.1%)
(1)纯碱样品中的Na2CO3的质量分数是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
如图是某胃药标签上的部分内容,兴趣小组欲测定该药品中碳酸氢 钠(NaHCO3)的质量分数,取10片该药品研碎放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(杂质不溶于水也不参加反应),共消耗稀盐酸23g,测得反应后烧杯内物质的总质量为25.8g。请计算:
(1)10片药品的质量为 g,反应共生成气体的质量为 g;
(2)药品中碳酸氢钠的质量分数.
(3)反应后所得溶液中溶质的质量分数.(计算结果保留到0.1%)
有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气。现将2.5g氧化铜与24.5g氯酸钾的混合物充分加热,残余固体经冷却、称量、质量为17.4g。然后将固体溶于65.1 g水中,充分搅拌,过滤得到滤液和黑色的滤渣。滤渣又经过洗涤、烘干、称量,质量为2.5g。(不考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起作用。
(2)生成的氧气为克。
(3)所得滤液中溶质是,其质量分数为。
(4)向所得滤液中加入质量分数为16%的
溶液恰好完全反应,需
溶液的质量为多少克?(列出必要的计算过程)
中老年人缺钙会患骨质疏松症。某补钙品(有效成分为碳酸钙,其它成分不含钙元素),其说明书中标明含钙量为30%。小斌同学为了检验该产品是否属实,于是取了5克补钙品放入盛有50克稀盐酸的烧杯中,其中的碳酸钙跟稀盐酸恰好完全反应(其它成分与稀盐酸不反应),反应后剩余固体和液体的总质量为54.56克。请你计算:(所有计算结果保留两位小数)
(1)碳酸钙中钙元素的质量分数 ;
(2)反应生成的二氧化碳质量 ;
(3)碳酸钙在补钙品中的质量分数,补钙品中的实际含钙量是否属实?
(4)所用盐酸中的溶质质量分数。
某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示。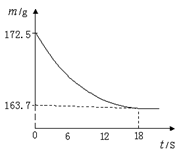
求:(1)计算碳酸钠中各元素的质量比:Na:C:O= 。
(2)碳酸钠的相对分子质量为: 。
(3)生成CO2的质量。
(4)该纯碱样品中Na2CO3的质量分数。
试题篮
()