向 的混合溶液中加入一定质量的铁粉,反应完成后,过滤,下列情况不可能存在的是
的混合溶液中加入一定质量的铁粉,反应完成后,过滤,下列情况不可能存在的是
| A.滤纸上有Ag、Cu、Fe,滤液中有Zn2+、Fe2+ |
| B.滤纸上有Ag、Cu,滤液中有Zn2+、Fe2+ |
| C.滤纸上有Ag、Cu,滤液中有Cu2+、Zn2+、Fe2+ |
| D.滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+ |
某合金由铝、铁、铜三种金属组成.现要测定一定质量该合金中铝的质量.设计以下流程并实验。
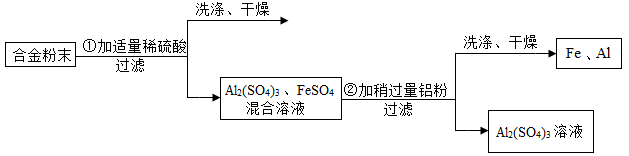
(1)通过以上实验也可验证三种金属的活动性顺序,写出判断依据.
(2)为什么要向合金粉末中加人适量的稀硫酸?
(3)为达到实验目的,需要称量上述流程中哪些物质的质量?如何确定铝的质量?
某食品包装中防腐剂的主要成分是铁粉和生石灰,某化学兴趣小组对一包久置的这种防腐剂固体样品进行探究。
【提出问题】久置固体的成分是什么?
【查阅资料】常温下,铁与氯化铁在溶液中发生反应生成氯化亚铁。
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究】方案一
| 实验操作 |
实验现象 |
解释或实验结论 |
| 取少量久置固体于试管中,加入足量的_________。 |
固体逐渐消失,有大量气泡产生,得到浅绿色溶液 |
固体中一定含有___ _,一定不含Fe2O3 |
有同学认为该方案并不能得出“一定不含Fe2O3”的结论,理由是:_____________________。
方案二:将久置固体研碎并用磁铁充分吸引,取剩余固体用足量蒸馏水溶解,过滤
| 实验操作 |
实验现象 |
解释或实验结论 |
| 1.取少量滤液于试管中,加入碳酸钠溶液 |
产生白色沉淀 |
反应的化学方程式是: ___________________ |
| 2.取滤渣于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水 |
①固体逐渐消失,有大量气泡产生,得到黄色溶液 ②澄清的石灰水变浑浊 |
固体中一定含有______ |
【反思评价】通过以上实验,仍然不能确定是否含有的物质是______________________。
将红色的铜丝放在酒精灯火焰的外焰上加热,铜丝表面变为黑色。下列说法错误的是()
| A. | 红色铜丝表面变黑,是因为生成了氧化铜 |
| B. | 红色铜丝表面变黑,是因为铜发生了还原反应 |
| C. | 立即把变黑的铜丝插入稀硫酸中,溶液会出现蓝色 |
| D. | 立即把变黑的铜丝插入酒精中,铜丝变回红色 |
某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、
S约占1.2%。现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示: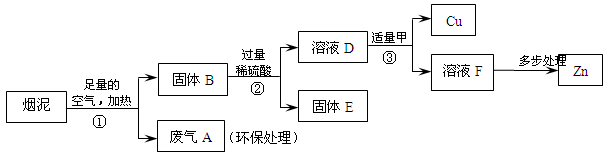
已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物;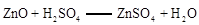 ;
;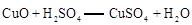
(1)步骤①产生的废气A中,一定含有的有害气体是_____。
(2)步骤③中反应的化学方程式是______________。
(3)下列说法正确的是__________。
a.②、③中的操作均包含过滤
b.溶液D和溶液F中ZnSO4的质量相等
c.溶液D中ZnSO4的质量大于CuSO4的质量
d.若步骤①中空气不足量,不会导致锌的回收率降低
验证金属Fe Cu Ag的活动性强弱,下列方案不能达到目的是
| A.Fe CuSO4溶液 Ag |
| B.FeSO4溶液 Cu AgNO3溶液 |
| C.Fe Cu AgNO3溶液稀盐酸 |
| D.FeSO4溶液 Cu Ag |
某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示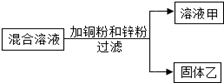
则:①溶液甲中一定含有Al(NO3)3和Zn(NO3)2;
②固体乙中一定含有Ag,可能含有Cu和Zn;
③若溶液甲是蓝色,则溶液甲一定含Al(NO3)3、Zn(NO3)2和Cu(NO3)2;
④向固体乙滴加稀盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2。上述四种说法正确的个数为
| A.4个 | B.3个 | C.2个 | D.1个 |
为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;
(2)发生反应的化学方程式为;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为;
(4)该黄铜样品中铜的质量分数是;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是,再经过某些反应及操作就得到了所需铜盐。
向 溶液中加入一定质量 的混合溶液,充分反应后过滤,得到滤渣和浅绿色滤液。下列说法正确的是()
| A. | 滤液中一定含有 |
| B. | 滤液中一定含有 |
| C. | 滤渣中一定含有 |
| D. | 滤渣中一定含有 |
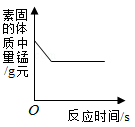
下列图像能正确反映对应变化关系的是
 |
 |
 |
 |
| A.一定质量的碳酸钠中不断加入盐酸 |
B.向一定质量的铜锌合金样品中不断加入稀硫酸 |
C.用酒精灯加热一定质量的高锰酸钾固体 |
D.向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液 |
如图所示,两只U型管中分别加入纯净、等质量的铝粉和铁粉,同时将两端注射器内的液体(等质量、浓度为20%的稀硫酸)快速注入U型管中。
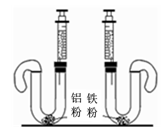
(1)写出铁粉与稀硫酸发生反应的化学方程式 。
(2)反应结束并冷却至室温,发现左端气球膨胀程度明显大于右端,若仅有一只U型管内的硫酸有剩余,则是 (填“左”或“右”)端的U型管。
(3)若将铝粉和稀硫酸换成其他两种化合物(或其溶液),也能观察到气球明显膨胀,这两种物质可能是(写化学式) 。
A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.A、B、C、D B.B、A、C、D C.D、C、A、B D.D、C、B、A
若将一定量的铁粉投入到入一定量只含有Cu(NO3)2、AgNO3的工业废水中,充分反应后过滤,向所得滤渣中滴加稀盐酸,没有气泡产生,则滤渣中一定含有的金属是 ;一定不含有的金属是 。
将一定质量金属M的粉末放入盛有硝酸铜溶液的烧杯中,充分反应后溶液呈无色;继续向烧杯中加入一定量的硝酸银溶液,待充分反应后过滤,得蓝色滤液和滤渣。根据实验分析,以下结论错误的是()
| A. | 金属活动性顺序:M> > |
| B. | 滤液中一定含有M的阳离子和 |
| C. | 滤渣中一定含有 和 |
| D. | 向滤液中滴加稀盐酸,可能产生白色沉淀 |
向一定质量的 和 的混合溶液中加入 克 ,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为 克。据此,下列说法不正确的是
| A. | 取反应后的滤液观察,滤液可能呈蓝色 |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 |
| C. | 取滤渣滴加稀硫酸,可能有气泡产生 |
| D. | 滤渣中的物质至少有两种 |
试题篮
()