初中阶段:物质得氧和失氧的反应是氧化还原反应;高中阶段:凡是有元素化合价升降的化学反应都是氧化还原反应.元素化合价升高的为还原剂,发生氧化反应;元素化合价降低的为氧化剂,发生还原反应;氧化反应和还原反应同时发生的,这样的反应称为氧化还原反应.请回答下列问题:
(1)根据化合价改变判断下列四种基本反应类型,一定不是氧化还原反应的是 .(选填序号)
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)下列化学反应中,属于氧化还原反应的是 (选填序号),该反应的还原剂是 (填化学式).
| A. |
Na 2CO 3+CaCl 2═CaCO 3↓+2NaCl |
B. |
Fe+CuSO 4═Cu+FeSO 4 |
| C. |
Ca(HCO 3) 2 |
D. |
CaO+H 2O═Ca(OH) 2 |
(3)下列反应中,氧化反应与还原反应在同一元素中进行的是 .(多选,选填字母序号)
| A. |
Cl 2+2NaOH═NaCl+NaClO+H 2O |
B. |
4P+5O 2 |
| C. |
Zn+CuCl 2═Cu+ZnCl 2 |
D. |
3NO 2+H 2O═2HNO 3+NO. |
在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如表
| 四种物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前质量(g) |
2 |
8 |
30 |
50 |
| 反应后质量(g) |
20 |
未测 |
39 |
23 |
(已知甲、丙两种物质的相对分子质量之比为1:1)
则下列说法正确的是( )
| A. |
该反应为化合反应 |
| B. |
待测值为18 |
| C. |
反应中丁和丙的质量比为3:1 |
| D. |
甲、丙两种物质化学计量数之比为1:2 |
化学科学的发展为人类创造了巨大的物质财富.我国涌现了许多化学家,他们的成就为世界所瞩目.侯德榜就是其中一位,他发明的联合制碱法,至今仍为世界各国所应用.联合制碱法的生产流程如图:
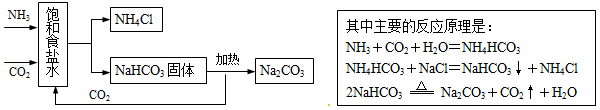
根据以上信息回答下面的问题:
(1)联合制碱法的原理中没有涉及的基本反应类型是什么?
(2)原料中的氯化钠在生活中的用途也很广泛,请你举出一例.
(3)侯德榜发明的联合制碱法有哪些优点(答出一点)?
下列叙述、对应的化学方程式、所属基本反应类型都正确的是( )
| A. |
电解水 2H 2O |
| B. |
硫酸铜溶液中滴加氢氧化钠溶液 CuSO 4+2NaOH═Cu(OH) 2↓+Na 2SO 4 复分解反应 |
| C. |
镁在空气中燃烧 2Mg+O 2 |
| D. |
氢气还原氧化铜 H 2+CuO═Cu+H 2O 置换反应 |
下列叙述正确的是( )
| A. |
无色透明的液体一定是溶液 |
B. |
催化剂只能加快化学反应速率 |
| C. |
有氧气参加的反应属于氧化反应 |
D. |
分子可分,原子不可分 |
黄铁矿的主要成分为二硫化亚铁(FeS 2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如图:
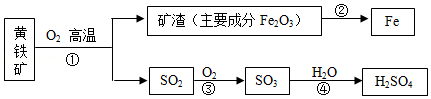
下列说法错误的是( )
| A. |
反应②不是置换反应,反应③④为化合反应 |
| B. |
反应①中各元素的化合价均发生了改变 |
| C. |
该工业生产过程产生的废气中的SO 2可以用熟石灰溶液吸收 |
| D. |
向制得的100克98%的浓硫酸中加入100克蒸馏水,配制49%的稀硫酸 |
对于反应NH 4NO 3+NaOH═NaNO 3+NH 3↑+H 2O.相关说法正确的是( )
| A. |
上述反应属于复分解反应 |
B. |
排放在空气中的氨气不会造成大气污染 |
| C. |
铵态氮肥与碱性物质混用,不会降低肥效 |
D. |
在NH 4NO 3中,氮元素化合价相同 |
质量守恒定律的发现,对化学的发展做出了重要贡献。

(1)通过分别称量下列两组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是 (填标号)a.大理石和稀盐酸 b.NaOH溶液和Na 2SO 4溶液
(2)在足量氧气中点燃镁条的实验过程中,固体质量变化如图一。
①从燃烧条件分析,固体质量在t 1前没有发生变化的原因是
②该反应的化学方程式为
③参加反应的氧气质量为 g
(3)在一定条件下,A和B反应生成C,微观示意图如图二。回答下列问题:
①一个A分子由 个原子构成
②C分子中原子的质量比N:O=
③该反应的化学基本反应类型为
④上述反应中一定发生改变的是 (填标号)
a.元素种类 b.原子种类 c.分子种类
空气中含量较高的气体是氮气和氧气,氮气和氧气在放电的条件下发生化学反应的微观模拟示意图如图所示:

请回答下列问题
(1)在B图中将相关粒子的图形补充完整。
(2)此变化中发生改变的粒子是 (填化学式)。
(3)结合该图示从微观角度解释由A到B的实质是 。
(4)生成物中氮元素的化合价为 价。
(5)该反应所属的基本反应类型为 。
(6)画出O 2 ﹣的结构示意图 。
赤峰人民翘首以盼的高铁即将开工建设,请结合所学知识,回答下列问题:
(1)高铁车厢质轻、强度大,是利用 制成(填"复合材料"或"无机非金属材料")。
(2)铝热剂是修筑铁路时常用的焊接材料,其反应原理是,铝在一定的条件下与氧化铁反应,得到熔融的铁和另一种氧化物,该反应的基本类型是 。
(3)某品牌的空气净化剂含有过氧化钠(Na 2O 2),它可以使车厢里的二氧化碳转化为碳酸钠和氧气,写出该反应的化学方程式 。
(4)高铁是以电能为动力来源的电动列车,它与以燃煤为动力来源的蒸汽列车相比,其优点是 (要求只答一条)。
稀硫酸、硫酸铜溶液、氢氧化钠溶液、铁钉是常见的四种物质,物质之间的反应关系如图所示。图中两圆相交部分(Ⅰ、Ⅱ、Ⅲ、Ⅳ)表示物质间两两反应。
(1)Ⅰ处反应属于基本反应类型中的 反应。
(2)Ⅱ处反应现象是溶液由蓝色变成浅绿色,铁钉表面 。
(3)Ⅲ处两种溶液反应,滴入酚酞试液后溶液变红,说明此溶液呈 性。
Ⅳ处反应的化学方程式是: 。

A~J是初中化学接触到的物质,各物质反应关系如图所示,其中A为最简单的有机物,X、Y分别为金属氧化物,G、H为金属单质,J为蓝色溶液(其中部分反应物、生成物、反应条件已略去,箭头所指为生成物),请回答下列问题:

(1)A的化学式 ;
(2)写出H+Z→J的化学方程式 。
(3)整个框图涉及到的基本反应类型有 种;
(4)写出F在实际生活中的一种用途。
以黄铁矿(主要成分为FeS 2)为原料生产硫酸的工艺流程如图所示:
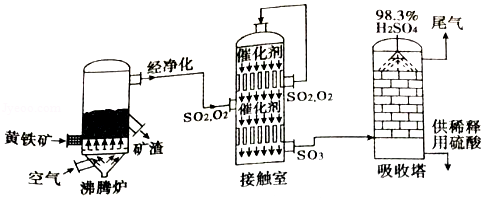
(1)沸腾炉中发生反应的化学方程式为:4FeS 2+11O 2 2X+8SO 2,其中X的化学式为 。
(2)接触室中发生反应的化学方程式为:2SO 2+O 2 2SO 3,产物SO 3中硫元素的化合价为 ;吸收塔中发生反应的化学方程式为:SO 3+H 2O═H 2SO 4,该反应的基本类型是 。若有800kg三氧化硫进入吸收塔中,且完全被吸收,则理论上制得硫酸的质量为 kg。
(3)O 2、SO 2、SO 3、H 2SO 4四种物质中属于氧化物的是 。
(4)实验室中稀释浓硫酸的操作是 。
以下是四个化学反应的微观示意图,图中不同的圆圈代表不同的原子,其中能表示置换反应的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
试题篮
()