现有反应:2Cu(NO3)2 2CuO+O2↑+4X↑,则X的化学式为( )
A.NOB.NO2C.NH3D.N2O3
Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X═Sb2O5+2H2O,则X的化学式为( )
A.H2B.H2O2C.O2D.H3SbO4
把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法正确的是( )
| 物质 |
a |
b |
c |
d |
| 反应前的质量(g) |
7.4 |
4.2 |
5.0 |
3.8 |
| 反应后的质量(g) |
6.2 |
x |
8.2 |
3.8 |
| A. |
物质a是生成物 |
B. |
x=2.2 |
| C. |
d一定是催化剂 |
D. |
反应后原子数目减少了 |
在一密闭容器中,有X、O 2、CO 2、H 2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质量如表.下列说法正确的是( )
| 物质 |
X |
O 2 |
CO 2 |
H 2O |
| 反应前的质量/g |
19 |
34 |
6 |
2 |
| 反应后的质量/g |
11 |
待测 |
28 |
20 |
| A. |
表中的待测值为32 |
B. |
|
C. |
|
| D. |
X中一定含有 |
E. | F. |
O元素 | |
| G. |
该反应是置换反应 |
H. |
|
I. |
|
| J. |
反应中CO 2和H 2O的质量比为11:9 |
K. |
|
L. |
|
"84消毒剂"是以次氯酸钠为主要有效成分的消毒液,制备次氯酸钠的原理可表示为:2NaOH+Cl 2═NaClO+X+H 2O,则X的化学式是( )
| A. |
Na 2O |
B. |
NaCl |
C. |
NaH |
D. |
NaClO 3 |
一定条件下,下列物质在密闭容器内反应一段时间,测得反应前后各物质的质量如下表:
| 物质 |
X |
Y |
Z |
W |
| 反应前质量/g |
22 |
34 |
0 |
2 |
| 反应后质量/g |
40 |
待测 |
16 |
2 |
根据上表信息判断,下列说法不正确的是( )
| A. |
该反应属于分解反应 |
| B. |
该反应中生成X的质量是40g |
| C. |
W在反应中可能是催化剂 |
| D. |
该反应中Y和Z的质量比为17:8 |
如图表示四种物质的密闭容器中反应一段时间后质量的变化,则其化学反应表达式可能是( )
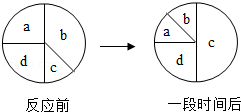
| A. |
a+b→c+d |
B. |
c→a+b |
C. |
a+b c |
D. |
c a+b |
三种物质在密闭容器中发生反应,反应前后质量比例的变化关系如图所示。下列说法正确的是( )

| A. |
反应中CaO为催化剂 |
| B. |
该反应是化合反应 |
| C. |
反应后容器中固体的质量减少 |
| D. |
反应后容器中氧元素的质量分数增大 |
电解氢氧化钠稀溶液与电解水的原理均可表示为:2H 2O 2H 2↑+O 2↑.电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是( )
| A. |
溶液的PH减小 |
| B. |
溶液中氢元素质量分数减少 |
| C. |
溶液中钠元素质量变大 |
| D. |
溶液中氢、氧元素质量比不变 |
现有部分被氧化的铜粉固体混合物,为研究铜粉的组成情况,取4g混合物,先加热完全氧化后,再加入60g9.8%的稀硫酸恰好完全反应,则固体混合物中铜单质的质量分数为( )
| A. |
80% |
B. |
64% |
C. |
16% |
D. |
96% |
下列过程中不发生化学变化的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
小柯做了一个趣味实验:他先将鸡蛋壳碾碎装入气球,再把气球套在盛有白醋的锥形瓶瓶口,然后把气球中的蛋壳加入锥形瓶中(装置的气密性良好),实验过程如图。下列对该实验的分析正确的是( )
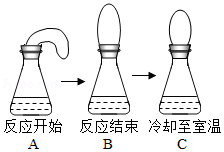
| A. |
不能验证质量守恒定律,因为气球受到浮力 |
| B. |
冷却至室温时,瓶内气体分子间空隙变大 |
| C. |
反应没有气体生成 |
| D. |
反应没有热量放出 |
如图是某化学反应的微观示意图。下列说法中错误的是( )

| A. |
甲是最简单的有机物 |
| B. |
反应前后原子种类没有发生改变 |
| C. |
反应生成的丙和丁的分子个数比为1:2 |
| D. |
一个甲分子是由两个氢分子和一个碳原子构成 |
"丹砂烧之成水银"中的"丹砂"指的是硫化汞。该反应的微观示意图如下,有关说法正确的是( )
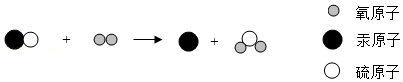
| A. |
"●"代表非金属单质汞 |
| B. |
此反应遵循质量守恒定律 |
| C. |
反应前后原子的种类发生改变 |
| D. |
反应前后各元素的化合价都不变 |
试题篮
()