碳酸钠俗称纯碱或苏打,在生活、生产和实验研究中均有广泛应用。
[配制溶液]配制溶质质量分数分别为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是 (填字母)。
a.用托盘天平称取2g Na2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 |
Ⅰ |
Ⅱ |
III |
溶质质量分数 |
1% |
2% |
4% |
溶液pH |
11.62 |
11.76 |
11.90 |
分析Ⅰ、Ⅱ、Ⅲ三组数据可得出的结论是 。
[制备物质]用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
[已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀]
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是 (填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:4FeCO3+6H2O+O2═4X+4CO2.则X的化学式为 。
[标定浓度]标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于lg•mL﹣1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将 (填“偏大”、“偏小”或“无影响”)。
某同学为给自家的蔬菜大棚补给二氧化碳,设计了如下方案:将稀释后的工业废液(主要成分的化学式用“X”表示)装入大塑料桶内,悬挂在高处,然后每天向其中加入一定量的碳酸氢铵,发生的化学反应方程式为:X+2NH4HCO3═(NH4)2SO4+2H2O+2CO2↑,则X的化学式为 。生成的(NH4)2SO4可作氮肥,不宜与Ca(OH)2等碱性物质混合施用的原因: (用化学方程式表示)。
2020年1月23日,永州首例新型冠状病毒感染的肺炎患者确诊后,全市实施居家隔离措施。在居家抗疫中,我们常使用浓度为75%的酒精(C2H5OH)和“84消毒液”(有效成分为NaClO)进行消毒杀菌。请回答下列问题:
(1)①在酒精分子中,C、H、O的原子个数比为 。
②下列对酒精性质的描述,属于化学性质的是 。
A.易挥发
B.消毒杀菌
C.无色有特殊香味
D.熔点﹣114℃、沸点78℃
(2)①“84消毒液”与厕所清洁剂(俗称“洁厕灵”,有效成分为稀盐酸)可发生反应:
NaClO+2HCl═NaCl+Cl2↑(有毒)+H2O
在使用过程中,这两种物质 (填“能”或“不能”)混合使用。
②在实验室可往NaOH溶液中通入Cl2制得“84消毒液”,请完成此反应的化学方程式:2NaOH+Cl2═NaClO+ +H2O
(3)在疫情防控中,你做了哪些有效的防护措施 (写一条即可)。
防疫情,测体温。体温测量仪功不可没。
(1)传统型﹣﹣体温计。含汞体温计将在2026年起全面禁止生产,因为汞是人体中的 (选填“必需”或“有害”)元素。汞的元素符号是 。
(2)方便型﹣﹣额温枪。某种额温枪的红外温度传感器所用材料含有钽酸锂(LiTaO3)。钽酸锂中锂元素(Li)的化合价为+1价,则钽元素(Ta)的化合价为 价。在惰性气氛中制取钽的原理为:5Na+K2TaF7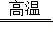 Ta+2KF+5R,则R的化学式为 。
Ta+2KF+5R,则R的化学式为 。
(3)快捷型﹣﹣红外热成像测温仪。该测温仪可实现远距离、多目标、非接触式测温,可用于快速筛查人群中的高温个体。
①该测温仪还可用于 。(填序号,双选)
A.测量物质溶解时的热量变化
B.分析赣江水质
C.探测炼铁高炉是否漏热
D.检测室内甲醛含量是否超标
②该测温仪外壳的塑料是热固性塑料。生活中检验热固性塑料的方法是 。
2020年6月23日9时43分,我国长征三号乙运载火箭将北斗系统第55颗导航卫星成功送入预定轨道,标志着我国北斗卫星导航系统正式建成。长征三号乙运载火箭是一种三级大型液体捆绑式运载火箭。它的第一、二级使用偏二甲肼(C 2H 8N 2)和四氧化二氮(N 2O 4)作为推进剂,其反应原理为:C 2H 8N 2+2N 2O 4 2CO 2+3X+4H 2O,反应放出大量的热产生推力,第三级则使用效能更高的液氢和液氧作为推进剂。请根据以上信息回答下列问题:
(1)四氧化二氮中氮元素的化合价为 ,物质X的化学式为 ;
(2)火箭第三级中发生反应的化学方程式为 。
医用消毒酒精为75%的乙醇溶液,化工生产中可用A(主要成分的化学式为C8H18)作原料,经以下流程制取乙醇:

(1)步骤①的转化属于 (选填“化学”或“物理”)变化。
(2)步骤②是乙烯和含两种元素的化合物B发生化合反应,则B中所含元素是 。
用化学用语填空:
(1)2个氢氧根离子 。
(2)高铁酸钠(Na2FeO4)是一种很好的净水剂,其中铁元素的化合价为 。
(3)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为2NaOH+X═NaClO+NaCl+H2O,则X的化学式为 。
(4)国际禁毒日,为了起到警示教育作用,某地警方将缴获的毒品进行了焚烧处理。毒品大麻(主要成分的化学式为C21H30O2)在空气中完全燃烧生成二氧化碳和水,其反应的化学方程式为 。
化学与生活、社会、环境密切相关。
(1)打开可乐瓶盖后,有大量气泡冒出,这种现象说明气体的溶解度与 有关。
(2)制备手机芯片的主要材料是硅,可以利用石英砂(主要成分是SiO2)制得,二氧化硅中硅元素的化合价是 。
(3)防疫期间,人们常用84消毒液【主要成分为次氯酸钠(NaClO)】对生活场所进行杀菌、消毒。工业上制备NaClO的反应原理为2NaOH+Cl2═X+NaClO+H2O,则X的化学式为 。
(4)山药中含有碱性皂角素,皮肤沾上会奇痒难忍。你认为可涂厨房中的 (填溶质名称)来止痒。
(5)煤燃烧时放出的二氧化氮、 (填化学式)等污染物,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成酸雨。
金属在生产、生活中应用广泛,金属的回收利用有利于保护环境、节约资源。
(1)用体温计测量体温时,水银柱会上升。用微观知识解释产生该现象的原因 。
(2)我国古代典籍中有“银针验毒”的记载。“银针验毒”的反应原理之一是:4Ag+2H2S+O2═2X+2H2O,X的化学式为 。
(3)某工厂欲从溶质是AgNO3和Cu(NO3)2的生产废液中回收Ag和Cu.实验员取样,向其中加入一定量的锌,充分反应后过滤,得到滤渣和滤液。
①若所得滤液为蓝色,则滤液中一定含有金属离子 (填离子符号)。
②若向所得滤渣中加入一定量稀硫酸产生气泡,则滤渣中一定含有 。
2020年5月5日,长征五号B运载火箭在海南文昌成功发射,该火箭采用无毒无污染的液氧、液氢和煤油作为推进剂,正式拉开我国载人航天工程“第三步”任务的序幕。
(1)液氢属于 (填“单质”“氧化物”或“混合物”);
(2)火箭用到了钛合金。工业制钛的一个反应为:TiF4+2H2SO4 4HF+2X+TiO2,X的化学式为 ,TiO2中Ti的化合价为 。
“新冠肺炎”疫情防控是一项长期的工作,不能松懈。
(1)一次性医用口罩阻隔病毒的关键材料熔喷布,是以聚丙烯为原料生产的。聚丙烯属于 (填“合成”或“复合”)材料。
(2)测量体温时,水银温度计的汞柱会升高。请从微观角度解释汞柱升高的原因,温度升高, 。
(3)“84”消毒液的消毒原理是NaClO+CO2+H2O═X+HClO,生成的HClO具有杀菌作用。化学方程式中X的化学式为 ,HClO中氯元素的化合价为 。
(4)注意环境卫生,学会垃圾分类。果皮、烂菜叶属于如图图示中的 (填序号)。

一些心脏病患者安装心脏起搏器,以在心跳骤停时刺激心脏,恢复心跳。一种用于心脏起搏器的锂电池,工作时发生的反应为4Li+2SOCl2═4LiCl+X+SO2↑.则X的化学式为 。
科学使用化学物质,可以保障人体健康。
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平[主要成分为Al(OH)3]治疗,其原理是 (用化学方程式表示)。
(2)某84消毒液产品的部分说明如下表。
84消毒液 [产品特点]主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.1%~6.9%。 [餐具消毒]用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 [注意事项]①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如洁厕类清洁产品)同时使用。 |
①依据表中信息,将有效氯的质量分数为6.0%的84消毒液与水按质量比为1: 进行稀释,即可用于餐具消毒。
②洁厕灵(主要成分为盐酸)与84消毒液混合会产生有毒的氯气(Cl2)。请将该反应的化学方程式补充完整:2HCl+NaClO═ +Cl2↑+H2O

阅读下面的短文,回答有关问题。
新型灭菌消毒剂﹣﹣ClO2
目前,新冠肺炎疫情肆虐全球。为抑制新冠病毒传播,“含氯消毒剂”被广泛使用,其中就包含一种新型灭菌消毒剂﹣﹣ClO2.在通常情况下,ClO2是一种有刺激性气味的黄绿色,气体,熔点﹣59℃,沸点11℃.在常温下,1L水中大约能溶解2.9g ClO2.ClO2受热或者见光易分解,具有强氧化性和很强的腐蚀性。含有2%的ClO2和0.085% Na2CO3的水溶液无色、无臭、无腐蚀性,常温下稳定,不易分解;该溶液用于杀菌、消毒的同时,还有除臭、防霉、保鲜等作用,是特性优良、高效安全的消毒剂。我国从2000年起就逐渐用ClO2取代氯气(Cl2)对饮用水进行消毒。
(1)ClO2的名称是 ,分子中氯元素的化合价是 。
(2)下列消毒剂中,不属于“含氯消毒剂”的是 (填字母序号)。
A.84消毒液(含NaClO)
B.双氧水
C.氯气
D.过氧乙酸(C2H4O3)
(3)ClO2的化学性质有 (写出两点即可)。
(4)下列有关ClO2的说法正确的是 (填字母序号)。
A.0℃时,ClO2为黄绿色气体
B.常温下,100g水中大约能溶解0.29g ClO2
C.用棕色试剂瓶盛装ClO2并置于冷暗处保存
D.ClO2溶液浓度越小杀菌效果越差
(5)ClO2遇热水生成次氯酸(HClO)和两种气态单质。完成该反应的化学方程式:8C1O2+2H2O + + 。
防范新冠疫情,需要我们"戴口罩,勤洗手,勤消毒,勤通风"。
(1)医用口罩的核心材料是聚丙烯制成的熔喷布,聚丙烯属于 (填"金属材料"或"有机合成材料");
(2)请从微现角度解释:教室进行消杀后室内充满消毒液气味的原因 ;
(3)某消毒液稀释后pH=6,则稀释前其pH (填">"、"="或"<")6;
(4)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,洗洁精的作用是 ;
(5)"84消毒液"的主要成分是次氯酸钠(NaClO)。其中氯元素的化合价是 ,制取NaClO的原理是2NaOH+Cl 2═NaClO+X+H 2O,其中X的化学式是 ;
(6)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液 kg,所需水的质量为 kg。
试题篮
()