化学不仅与公民的日常生活密切相关,也是推进社会文明和科学技术进步的重要力量。
(1)"智能蒸汽熨斗"可以定时加热,自动停止,自动调控蒸汽量大小,减少了向水槽中注水的次数。从微观角度看,水槽中水逐渐减少的原因是 ,据此推测可能影响微粒运动的快慢的因素是 。
(2)我国科学家研究表明,某种虫子以塑料为食,能将聚乙烯、聚苯乙烯等降解矿化为CO 2.聚乙烯、聚苯乙烯属于 材料;昆虫降解塑料属于 变化,它可有效解决的环境问题是 。
(3)氢能是一种极具发展潜力的清洁能源。分解水制氢的一种原理如图所示:
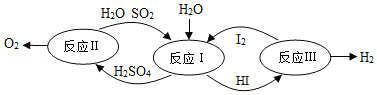
①反应I中,反应前后化合价发生改变的元素有 。
②反应Ⅲ的反应类型为 。
③理论上,每生成32gO 2能得到 gH 2。
读图识图是学习化学的重要手段。下列四个图象中不能正确反映对应变化关系的是( )
A. 向一定量的饱和石灰水中加入少量生石灰
向一定量的饱和石灰水中加入少量生石灰
B.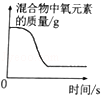 加热氯酸钾和二氧化锰的混合物制取氧气
加热氯酸钾和二氧化锰的混合物制取氧气
C.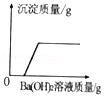 向一定量的稀盐酸和硫酸钠的混合溶液中加入Ba(OH)2溶液
向一定量的稀盐酸和硫酸钠的混合溶液中加入Ba(OH)2溶液
D. 将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
向一定量盐酸和氯化铁溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( )
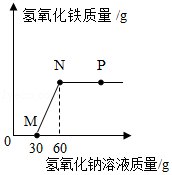
A.M点表示的溶液中只含有一种溶质
B.N点表示的溶液pH=7
C.P点和N点表示的溶液中,NaC1的质量分数相同
D.从M点到N点溶液质量增加30g
为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验:取50克滤液于烧杯中,先向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着向烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
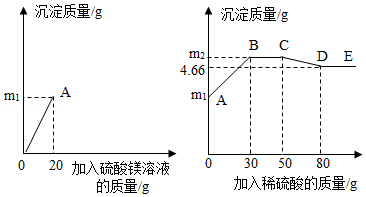
(1)滤液X的pH 7(选填"大于"、"等于"或"小于")
(2)CD段发生反应的化学方程式为 。
(3)滤液X中含有的溶质是 。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m 2的值为多少?(写出计算过程)
室温时,往盛有10.6g碳酸钙和氧化钙混合粉末的烧杯中加入100g稀盐酸,恰好完全反应,得到108.4g该温度下的不饱和溶液,则下列判断不正确的是( )
A.生成CO2为2.2g
B.原固体混合物中钙元素为6g
C.所得溶液中溶质的质量为15g
D.所加稀盐酸的溶质质量分数为10.95%
"加氢几分钟,畅行数百里",这是2021上海车展上为氢能源汽车打出的标语。氢能源汽车使用的是氢燃料电池(如图所示)。电池工作时在催化剂的作用下,氢原子失去电子形成氢离子,穿过电极A通过电解液移动到电极B与氧离子结合形成水分子;而电子则从电极A经外部电路通过电动机  到达电极B,形成电流。
到达电极B,形成电流。
(1)氢燃料电池工作时是将化学能直接转化为 能。
(2)氢气是氢燃料电池的原料,可以在用电低谷时,利用电网多余电能电解水来制取。已知1.2kg氢气大约可供某款氢能源汽车行驶100km,请根据化学方程式计算,制取1.2kg氢气至少需要电解多少质量的水。
(3)氢燃料电池工作时,通过电动机的电流方向是: 。
(4)世界能源组织提出:在制氢过程中基本上没有碳排放而得倒的氢气称为绿氢。下列方式可制得绿氢的是 。
| A. |
水力发电制氢 |
| B. |
太阳能发电制氢 |
| C. |
火力发电制氢 |
| D. |
核能发电制氢 |

氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
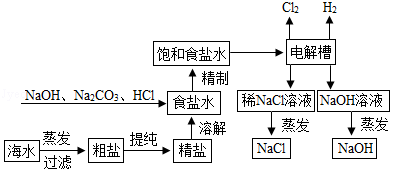
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
22等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
23和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
23的原因是 23,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法错误的是( )

A.该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中
B.m点表示氧化铜与稀盐酸恰好完全反应
C.m点和n点对应溶液中铜元素的质量不相等
D.m点和n点对应溶液蒸发结晶后得到的固体成分相同
下列图像能正确反应其对应关系的是( )
A.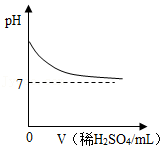 表示向一定质量的Ba(OH)2溶液中逐滴加入稀H2SO4至过量
表示向一定质量的Ba(OH)2溶液中逐滴加入稀H2SO4至过量
B.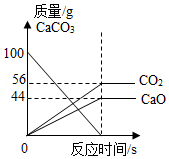 表示发生的反应为:CaCO3
表示发生的反应为:CaCO3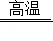 CaO+CO2↑
CaO+CO2↑
C. 表示等质量且过量的锌粉和铁粉,分别与质量和质量分数都相同的稀硫酸反应
表示等质量且过量的锌粉和铁粉,分别与质量和质量分数都相同的稀硫酸反应
D. 表示向盛有MnO2的烧杯中加入H2O2溶液
表示向盛有MnO2的烧杯中加入H2O2溶液
某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g;
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
一定质量M、N两种金属,分别与相同质量和相同质量分数的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示。分析图象得到的以下结论中,不正确的是( )

A.两种金属的活动性:M>N
B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N
D.充分反应后,得到溶液的质量:M=N
金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业、一般情况下,铝合金的强度和硬度比纯铝 (填“高”或“低”)。
(2)交通:制造港珠澳大桥需要大量的钢铁,请写出一种防止钢铁生锈的方法: 。
(3)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤出的滤液中一定含有金属离子是 。
(4)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有铜锌合金质量20克,与100克质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为 。
在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系见图。综合以上信息得到以下结论,合理的是( )

A.从图象可以看出,金属镁比金属锌的活动性强
B.若两种金属都有剩余,二者得到的氢气质量相同
C.若硫酸有剩余,二者得到氢气的质量相同
D.若两种金属完全溶解,二者消耗硫酸的质量相同
中国古代四大发明之一的"黑火药"是由木炭(C)、硫粉(S)和硝酸钾(KNO 3)按一定比例混合而成。
(1)分类。下列关于"黑火药"说法正确的是 。
a."黑火药"由"黑火药分子"构成
b."黑火药"中的KNO 3属于复合肥料
c."黑火药"中的C、S不再保持各自的化学性质
(2)变化。"黑火药"爆炸时发生的主要反应是:S+2KNO 3+3C═K 2S+N 2↑+3 ↑。
①依据质量守恒定律,空格上缺少的物质是 (填化学式)。
②"黑火药"爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为 。
(3)制备。古代曾用硝土(含有Ca(NO 3) 2、少量NaCl等)和草木灰(含有K 2CO 3)作原料制取KNO 3.某化学兴趣小组设计了如图实验流程:
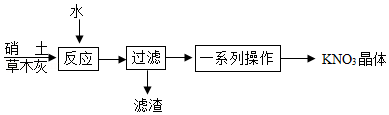
①"反应"过程中的化学方程式为 。
②"过滤"操作必须用到的玻璃仪器有烧杯、玻璃棒和 。
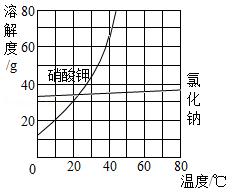
③如图是硝酸钾和氯化钠的溶解度曲线。"一系列操作"包括"加热蒸发浓缩、再冷却到一定温度、过滤"等步骤。其中"冷却到一定温度"能获得纯度较高的硝酸钾晶体的原因是 。
(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C 3H 5O 9N 3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为 。
合成硝化甘油的化学方程式为C 3H 8O 3+3HNO 3═C 3H 5O 9N 3+3H 2O.现用46kg甘油(C 3H 8O 3)和足量硝酸反应,理论上能生成多少硝化甘油?(写出计算过程)
试题篮
()