实验室需要氧气做实验。现将24.5 g氯酸钾和5.5克二氧化锰的混合物放入试管中加热完全分解,试计算:
(1)制得氧气的质量
(2)完全反应后试管中剩余固体物质有哪些?各为多少g?
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙。他们为了测定水垢中碳酸钙的含量,将足量的盐酸加入到12.5g水垢中,产生CO2的情况如图所示。
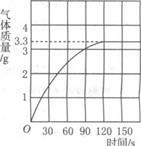
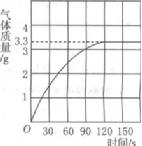
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?(写出详细解题过程)
工业上利用高温分解石灰石(主要成分CaCO3,杂质不参与任何反应),得到生石灰。现实验室利用此原理来分析石灰石的纯度,使用100g原料,完全分解后得到固体64.8g,计算:
(写出计算过程)
(11)反应中得到的二氧化碳气体的物质的量为多少摩尔?
(12)原料中的碳酸钙纯度为多少?
加热50g氯酸钾和2g二氧化锰混合物制取氧气,一段时间后,剩余固体质量为32.8g,求反应生成的氯化钾的质量。
在实验室里加热30g氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体的质量为20.4g。请计算:
(1)生成氧气的质量为_________;
(2)原混合物中氯酸钾的质量。
取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16.4g,计算:
(1)生成氧气的质量。
(2)原混合物中氯酸钾和二氧化锰的质量。
为了探究镁的性质,在锥形瓶(如图)中注入足量的稀盐酸(其溶质为HCl),在锥形瓶口紧系一气球,气球内盛有一定质量的单质镁碎屑。(提示:Mg+2HCl=MgCl2+H2↑)试根据要求回答下列问题:

(1)将气球内的单质镁全部倒入锥形瓶中。写出观察到的一项实验现象: 。
(2)倒入单质镁,反应结束后,整个装置与之前相比较 (填写下列各项的序号)。
①没有变化 ②有变化,后者质量变小 ③有变化,后者质量变大 ④不能确定
(3)若想制取2 g的氢气,需要镁的质量是多少?
欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是 合金;
(2)取该合金的粉末26g加入该硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,则

①生成气体的质量为 g.
②请计算:该合金中铜的质量分数;合金与酸恰好完全反应时所得溶液的溶质质量分数。
(写出计算过程)
将24g由木炭和氧化铜组成的混合物充分加热,其中木炭完全反应,反应结束后将剩余物冷却, 称得固体质量为19.6g,请计算:
(1)生成二氧化碳 。
(2)生成单质铜多少克?
(1)用氯酸钠(NaClO3)和盐酸反应可制得二氧化氯,反应方程式:
2 NaClO3+ 4HCl = 2 ClO2↑+ Cl2↑ + 2X + 2 NaCl ,请推断出X的化学式为
(2)汽车尾气(含有CO,SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个“催化转换器”,其特点是使CO和NO反应,生成一种空气中含量最多的气体,另一种可参与植物光合作用的气体。写出CO与NO反应的化学方程式是___ ____ 。
(3)自来水消毒过程中通常会发生如下化学反应,其反应的微观过程可用下图表示:

①请写出甲图所示反应的化学方程式 ;
②乙图所示反应的基本反应类型为 ;
③你能总结出的一条结论是 。
(4)实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制二氧化硫气体。二氧化硫气体是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成亚硫酸(H2SO3)。
①试写出实验室制取二氧化硫气体的化学方程式:_______________(与碳酸钙与盐酸的化学反应相似)
②制取二氧化硫时,发生装置应选用下图所示的 装置(填代号,下同);收集二氧化硫气体时,应选用下图所示 的装置。

(5)称取12.5 g石灰石(主要成分是CaCO3,杂质不参加反应)放人烧杯中,向其中加入50 g稀盐酸,二者恰好完全反应。反应结束后称量 烧杯中剩余物质的总质量为58.1 g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中CaCO3的质量分数
石灰石常见的矿产之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数(石灰石中所含的杂质既不溶于水也不与稀盐酸反应),取来了一些矿石样品,并取稀盐酸400 g,平均分成4份,进行实验,结果如下:
| 稀盐酸 |
第l份 |
第 2份 |
第 3份 |
第4份 |
| 加入石灰石样品的质量/g |
10 |
2O |
30 |
40 |
| 生成C02的质量/g |
3.52 |
7.04 |
8.8 |
m |
(1)上表中m的数值是 ;
(2)试计算这种石灰石矿中碳酸钙的质量分数。(写出计算过程)
MCO3广泛应用于建筑工业。
(1)某碳酸盐样品MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(友情提醒:①MCO3 ==MO+CO2↑②,不考虑植物油中溶解CO2产生的影响)。③不考虑装置中的空气对实验的影响

①连接装置并___________;②准确称量样品的质量10g;③装药品,_________________,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
Ⅰ.请将上述实验步骤补充完整①________________;③_________________
Ⅱ.B装置量气管上方少量植物油的作用是 ___________;
Ⅲ.步骤⑥中调节液面相平的操作是将水准管____________(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若其他操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是 ___________(填字母序号);
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)某研究小组使用上述装置测定M的相对原子质 量,测得3组数据如下表所示。取3组数据的值(这样做的目的是为了减少实验误差)得到CO2的体积为 __________L。又知常温常压下CO2的密度为1.964 g/L,则生成CO2的质量约是____________g(结果保留一位小数),据此计算M的相对原子质量的值。(写出计算M相对原子质量的过程)。
| 组别 |
样品质量 |
CO2体积 |
| 第1组 |
10 g |
2.239 L |
| 第2组 |
10 g |
2.241 L |
| 第3组 |
10 g |
2.240 L |
如图是某厂生产的加钙食盐包装标签上的部分文字说明,请仔细阅读并计算:
为了测定此食盐中的钙元素含量,取10g这种食盐溶于水,加入足量的稀盐酸,生成0.132g二氧化碳,请计算此加钙食盐中碳酸钙的质量分数.
试题篮
()