某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g;
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
为测试学生的实验和计算能力,老师准备了一瓶没有贴标签的过氧化氢溶液,同学们取部分溶液进行了如图实验,请结合实验回答下列问题:

(1)上述实验过程中发生反应的化学方程式为 。
(2)产生氧气的质量为 g。
(3)根据生成氧气的质量列出求解参加反应的过氧化氢质量(x)的比例式 。
(4)计算上述过氧化氢溶液中溶质的质量分数,并填写在答题卡的标签上(标签样式如图) 。

(5)若配制上述浓度的过氧化氢溶液300g,需要30%的过氧化氢溶液 g。
现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数为 。
(2)反应后所得溶液中氢氧化钠的质量。
“7150灭火剂”(C3H9B3O6,相对分子质量为174)以雾状形式喷射到燃着的金属时,立即发生燃烧反应:2C3H9B3O6+9O2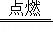 3B2O3+9H2O+6CO2。反应能很快耗尽金属物质附近的氧气,生成的玻璃状B2O3覆盖在金属物品表面而隔绝空气,从而有效灭火。若充分燃烧348g“7150灭火剂”,会消耗常温下的氧气多少升?(常温下氧气密度约为1.4g•L﹣1,结果保留一位小数)
3B2O3+9H2O+6CO2。反应能很快耗尽金属物质附近的氧气,生成的玻璃状B2O3覆盖在金属物品表面而隔绝空气,从而有效灭火。若充分燃烧348g“7150灭火剂”,会消耗常温下的氧气多少升?(常温下氧气密度约为1.4g•L﹣1,结果保留一位小数)
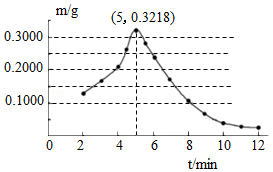
某简易制氧装置的示意图如图,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。
(1)装置中过滤层的作用是 。
(2)若产氧药块由氯酸钾(KClO3)和二氧化锰等组成,为得到一个人呼吸2小时所需氧气的量(折算后质量为48g),计算产氧药块中至少含氯酸钾的质量(写出计算过程)。
根据如图所示的实验过程和提供的数据进行计算:

(1)原混合物中NaCl的质量。(要求写出计算过程)
(2)AgNO3溶液溶质质量分数为 (精确到0.1%)
将91.6g氢氧化钾溶液与一定质量的氯化镁溶液混合,恰好完全反应,过滤后,得到11.6g沉淀和280g滤液,求氯化镁溶液的溶质质量分数.
向182.5g一定浓度的盐酸中加入一定量的锌粉(杂质不溶于水也不与盐酸反应)
| 加入锌粉的质量/g |
7.0 |
14.0 |
21.0 |
28.0 |
35.0 |
42.0 |
| 溶液的质量/g |
188.8 |
195.1 |
a |
207.7 |
214.0 |
214.0 |
分析数据,试计算[第(2)问需写出计算过程]
(1)a= 。
(2)盐酸中溶质的质量分数?
某工厂化验室用稀硫酸处理造纸厂产生含有氢氧化钠的废水.现称取废水样品80g倒入烧杯中,逐滴加入10%的稀硫酸至恰好完全反应,消耗稀硫酸98g.(反应的化学方程式:H 2SO 4+2NaOH═Na 2SO 4+2H 2O)
(1)氢氧化钠中氧元素的质量分数是 ;
(2)求废水中氢氧化钠的质量分数(要写出计算过程).
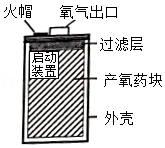
某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸(该产品中其它物质不与NaOH反应),消耗氢氧化钠溶液的质量与反应过程中溶液的pH值关系如图所示。
(1)图中A点表示的意义是 。
(2)A点消耗氢氧化钠溶液的溶质的质量为 g。
(3)求石油产品中残余硫酸的质量(写出计算过程)。
一定质量的金属铁和稀硫酸恰好完全反应,产生气体的质量为0.2g
(1)反应后溶液中溶质FeSO4的质量为 g.
(2)向反应后的溶液中加入BaCl2溶液,当加入的BaCl2溶液质量为208g时,恰好完全反应,此时生成沉淀的质量为 g.
(3)计算所加BaCl2溶液的溶质质量分数 .
盐酸、氢氧化钠是常见的酸碱。
(1)盐酸溶液中阳离子符号是 ,氢氧化钠的俗称是 (写一种)。
(2)向稀氢氧化钠溶液中滴入酚酞溶液。当滴入稀盐酸至完全中和时。溶液的颜色变化是 ,取少量中和后的溶液加热蒸干,现象是 。
(3)根据化学方程式计算,含HCl 7.3g的稀盐酸可中和氢氧化钠的质量为多少?
试题篮
()