现有一定质量的碳酸钠和氯化钠的固体混合物,其中含氯元素7.1g。向该混合物中加入138.1g一定溶质质量分数的稀盐酸,恰好完全反应,得到氯化钠溶液并生成4.4g气体。计算:
(1)原固体混合物中氯化钠的质量;
(2)反应后所得溶液中溶质的质量分数。
在82.8克碳酸钠溶液中,逐滴加入盐酸,所加盐酸的质量与产生气体的质量关系如图所示(滴加过程中先发生化学反应:Na2CO3+HCl═NaHCO3+NaCl)。试计算(不考虑气体的溶解和盐酸的挥发):

(1)m的值为 。
(2)刚好不再产生气体时,溶液中溶质的质量分数(写出化学方程式及计算过程)。
某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取100g样品完全溶解于313.6g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30g,充分反应。测得实验数据如下表所示:
(注:发生反应的化学方程式为MgCl2+2NaOH═Mg(OH)2↓+2NaCl)
次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
加入氢氧化钠溶液的质量/g |
30 |
30 |
30 |
30 |
30 |
累计生成沉淀的质量/g |
2.9 |
5.8 |
8.7 |
11.6 |
11.6 |
请完成下列各题:
(1)第 次恰好完全反应。
(2)样品中MgCl2的质量是 g。
(3)计算恰好完全反应时所得溶液的溶质质量分数(写出规范的计算过程)。
学习小组的同学通过如图实验测定一瓶失去标签的稀硫酸中溶质的质量分数。
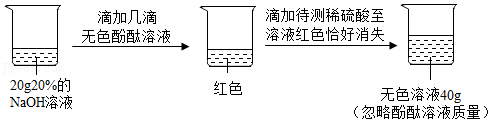
请完成下列分析与计算:
(1)反应中用去稀硫酸的质量为 g。
(2)计算稀硫酸中溶质的质量分数。
为测定某镁矿石中镁元素的质量分数,兴趣小组的同学取了5g该镁矿石粉末,加入过量的稀硫酸,充分反应后过滤、除杂,得到只含有MgSO4和H2SO4两种溶质的混合溶液100g,将该100g混合溶液放于烧杯中,然后取40g氢氧化钠溶液,分4次加入到盛有100g混合溶液的烧杯中,充分反应,测得的实验数据如下表所示:
实验编号 |
第一次 |
第二次 |
第三次 |
第四次 |
加入氢氧化钠溶液质量/g |
10 |
10 |
10 |
10 |
烧杯中生成沉淀的总质量/g |
0.464 |
1.044 |
1.160 |
1.160 |
请计算:
(1)100g混合液中硫酸镁的质量。
(2)该镁矿石中镁元素的质量分数。(假设5g镁矿石中的镁元素全部转化为100g混合溶液中MgSO4中的镁元素)
(3)加入的氢氧化钠溶液的溶质质量分数。
用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
加入CaCl2溶液的质量/g |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
反应后溶液的总质量/g |
118.0 |
136.0 |
154.0 |
M |
191.0 |
211.0 |
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
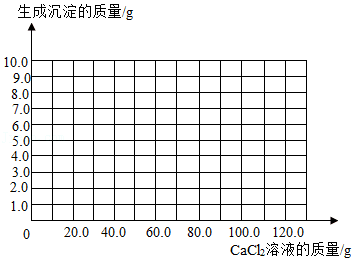
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
为测定某盐酸的溶质质量分数,取200g样品于烧杯中,将50g碳酸钠溶液分为5等份,分5次加入盛有样品的烧杯中。测出每次反应后溶液的总质量,实验数据如下表:
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
加入Na2CO3溶液的质量 |
10g |
10g |
10g |
10g |
10g |
反应后溶液的质量 |
208.9g |
217.8g |
226.7g |
235.6g |
245.6g |
请根据实验数据计算盐酸的溶质质量分数。
欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

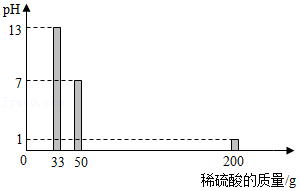
某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)当pH=13时,溶液中所含的溶质是 (填化学式)。
(2)当恰好中和时,消耗的稀硫酸的质量为 。
(3)计算该炉具清洁剂中氢氧化钠的质量分数(写出计算过程)。
实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。
(1)某兴趣小组打算用如图所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水 g。
(2)在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是 。
(3)为测定该瓶溶液的溶质质量分数,他们取35g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):
反应时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
锥形瓶+瓶内物质的总质量/g |
340.00 |
338.78 |
335.64 |
335.28 |
335.20 |
335.20 |
335.20 |
请回答:
①反应生成氧气的总质量为 g。
②该瓶过氧化氢溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)

某同学取110g K2CO3溶液于烧杯中,向其中加入CaCl2溶液。反应过程中加入CaCl2溶液与生成沉淀的质量关系如图所示。
请计算:
(1)m的值是 。
(2)恰好完全反应时,所得溶液的溶质质量分数是多少?(写出计算过程,结果精确到0.01%)

小明用含碳酸钠的氢氧化钠样品进行了如图所示的实验。请回答:

(1)此实验中发生反应的化学方程式是 ;
(2)过滤后滤液中溶质为 ,其质量分数是 。
某品牌补钙剂的主要成分是碳酸钙,实验小组的同学取该补钙剂2.5g,加入溶质质量分数为7.3%的稀盐酸至不再有气泡产生,共收集到二氧化碳0.88g(补钙剂中其他成分均不与稀盐酸反应)。请计算。
(1)该补钙剂中碳酸钙的质量分数。
(2)所用稀盐酸的质量。
国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了如图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)

(1)溶解时玻璃棒的作用是 。
(2)实验中加入过量CaCl2溶液的目的是 。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。
①过滤时得到的滤液浑浊,原因可能是 ;(任写一种)
②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果 。(选填“偏大”、“不变”或“偏小”)
以某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4•7H2O,流程如图:

(1)“酸浸”时,为了提高浸取率,除了搅拌、提高硫酸浓度外,还可采取的措施有
(写出一种)。此时,MnCO3发生反应的化学方程式是 。
(2)“转化”时主要反应是NaClO+MnSO4+H2O═MnO2↓+NaCl+H2SO4,氯元素反应前后化合价变化情况是 (填“升高”或“降低”)。
(3)硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体:
温度/℃ |
﹣3.9~1.8 |
1.8~48.1 |
48.1~67.5 |
67.5~200 |
析出晶体 |
MgSO4•12H2O |
MgSO4•7H2O |
MgSO4•6H2O |
MgSO4•H2O等 |
①“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、 、过滤、洗涤、低温干燥。
②“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是 H2SO4 (填化学式)。循环使用的目的是 。
(4)已知:MgSO4•7H2O中镁元素质量分数为9.76%。采用热分析法测定所得MgSO4•7H2O样品中镁元素质量分数:
①未加热前,测得样品中镁元素质量分数略大于9.76%,可能的原因是 。
②高于900℃后,测得剩余固体中镁元素质量分数大于20%,可能的原因是 。
(5)若用100t菱镁矿石可制得246t MgSO4•7H2O产品,忽略反应过程中镁元素损失,求该菱镁矿石中MgCO3的质量分数。(写出计算过程)
试题篮
()