向53g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为5%的稀盐酸,生成二氧化碳的质量随加入盐酸质量的变化关系如图所示。(不考虑CO 2的溶解)
已知:
OB段反应的化学方程式为Na 2CO 3+HCl═NaCl+NaHCO 3
BD段(不含B点)反应的化学方程式为NaH CO 3+HCl═NaCl+H 2O+CO 2↑
请回答:
(1)53g质量分数为10%的碳酸钠溶液中溶质质量为 g。
(2)A点对应溶液中溶质有 (填化学式)。
(3)B点横坐标为 (计算结果保留1位小数,下同)
(4)假设C点横坐标为54.75,计算C点对应的二氧化碳质量。(写出计算过程)

小苏打是发酵粉的主要成分之一,可用于制作发面食品。一化学兴趣小组对某小苏打样品中各成分的含量做了如下测定:将一定质量的该样品(已知杂质只含NaCl)加水全部溶解后,得到104.4g溶液,向该溶液中逐渐加入稀盐酸,产生的气体与加入稀盐酸的质量关系如图所示。试计算:
(1)m的值为 。
(2)当恰好完全反应时,所得溶液的溶质质量分数为3%,求原小苏打样品中NaHCO 3与NaCl的质量比 。

小兰进行水的电解实验时,在水中加入少许硫酸钠以增强导电性。她将2.7g硫酸钠固体加入52.7g水中充分溶解,倒入电解器中通电,当正极产生4.8g氧气时结束实验。忽略气体在水中的溶解,请计算(写出计算过程):
(1)负极产生氢气的质量;
(2)实验结束时所得溶液的溶质质量分数。
氧化钴(CoO)溶于盐酸可得到粉红色的氯化钴(CoCl 2)溶液。CoCl 2含结晶水数目不同而呈现不同颜色。利用蓝色的无水CoCl 2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的六水氯化钴晶体(CoCl 2•6H 2O)受热分解时,剩余固体质量随温度变化的曲线。
已知:①CoCl 2•6H 2O的相对分子质量为CoCl 2和6个结晶水的相对分子质量之和。

②CoCl 2•6H 2O受热分解完全脱水的化学方程式为:CoCl 2•6H 2O  CoCl 2+6H 2O。
CoCl 2+6H 2O。
请回答:
(1)CoCl 2的钴元素的化合价为 价。
(2)求物质A(CoCl 2•xH 2O)中的x值。
工业上常用熟石灰(主要成份:Ca(OH) 2)和纯碱(主要成份:Na 2CO 3)混合加工制取烧碱(化学式:NaOH)。请问:工业上制取40吨烧碱,需要消耗含Na 2CO 3质量分数为90%的纯碱多少吨?(计算结果保留一位小数)
现有一瓶敞口放置在空气中的NaOH固体,欲知其组成成分,取样品9.3克向其中逐渐加入一定质量分数的稀盐酸,产生气体的质量与加入稀盐酸质量关系如图所示,试回答;
(1)产生二氧化碳气体的质量为 克。
(2)所用稀盐酸溶质质量分数。
(3)求样品中氢氧化钠的质量分数。(精确到0.1%)

某课外兴趣小组为了测定当地石灰石中CaCO 3的质量分数,取25g石灰石样品,粉碎后,将100g一定质量分数的稀盐酸分5次加入到该样品中,所测数据如下表所示(杂质不与稀盐酸反应,也不溶于水):
| 次数 |
一 |
二 |
三 |
四 |
五 |
| 加入稀盐酸的质量/g |
20 |
20 |
20 |
20 |
20 |
| 产生气体的质量/g |
2.2 |
4.4 |
6.6 |
8.8 |
8.8 |
(1)生成CO 2的质量为 g;
(2)第 次恰好完全反应;
(3)求石灰石样品中CaCO 3的质量分数。
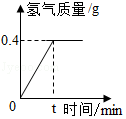
氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为2NaCl+2H 2O  Cl 2↑+H 2↑+2NaOH.现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
Cl 2↑+H 2↑+2NaOH.现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
(1)氯化钠完全反应时,生成氢气的质量是 g。
(2)氯化钠完全反应时,生成氢氧化钠的质量是 g。
(3)原氯化钠溶液中溶质的质量分数是多少?
向182.5g一定浓度的盐酸中加入一定量的锌粉(杂质不溶于水也不与盐酸反应)
| 加入锌粉的质量/g |
7.0 |
14.0 |
21.0 |
28.0 |
35.0 |
42.0 |
| 溶液的质量/g |
188.8 |
195.1 |
a |
207.7 |
214.0 |
214.0 |
分析数据,试计算[第(2)问需写出计算过程]
(1)a= 。
(2)盐酸中溶质的质量分数?
某石灰水中含有氢氧化钙0.74g,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,至少需要二氧化碳的质量是多少?
生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%﹣4.3%,钢含碳量为0.03%﹣2%).将一块质量为5.8g的铁合金放入烧杯中,再向烧杯中加入98g稀硫酸,恰好与铁合金中的铁完全反应,所得氢气的质量为0.2g,通过计算回答:该铁合金是生铁还是钢?(写出计算过程,结果精确到0.1%)
小新用20g含碳酸钠53%的天然碱制取氢氧化钠用于制作"叶脉书签"(杂质不参加反应)。操作过程如下:
请计算:

(1)20g样品中碳酸钠的质量为 g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
(3)将200g滤液浓缩成制作"叶脉书签"所需质量分数为10%的氢氧化钠溶液,需蒸发水 g。
小新用20g含碳酸钠53%的天然碱制取氢氧化钠用于制作"叶脉书签"(杂质不参加反应)。操作过程如下:
请计算:

(1)20g样品中碳酸钠的质量为 g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
(3)将200g滤液浓缩成制作"叶脉书签"所需质量分数为10%的氢氧化钠溶液,需蒸发水 g。
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
| 样品编号 |
① |
② |
③ |
④ |
| 稀盐酸的质量 |
25g |
50g |
m(80<m<150) |
150g |
| 剩余固体的质量 |
7.5g |
5g |
2g |
2g |
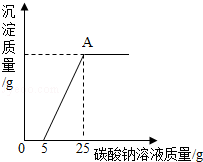
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的 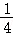 于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为 .
(2)编号③所用稀盐酸的质量m为 g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
试题篮
()