某研究小组欲检验草酸晶体样品分解产物并测定器质量分数(假设杂质不参与反应)。草酸晶体( H2C2O4•2H2O)的理化性质见表。
| 熔点 |
沸点 |
热稳定性 |
与澄清石灰水反应 |
| 101°C~102°C |
150°C~160°C升华 |
100.1°C失去结晶水,175°C分解成CO2,CO,H2O |
与Ca(OH)2反应产生白色沉淀(CaC2O4) |
(1)加热分解草酸晶体最适宜的装置是____________(填图1字母序号)。
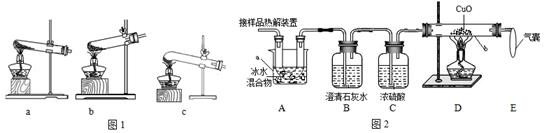
(2)图2是验证热分解产物中含CO,CO2的装置
①仪器a和b的名称分别是____________和____________。
②证明存在CO2的现象是________________________,证明存在CO的现象____________,D中反应的化学方程式是_____________。
③装置A的作用是____________________,气囊的作用是________________________。
(3)为测定样品中草酸晶体的质量分数,设计两种如下方案。
①称一定量样品用上图装置进行实验,测得装置D反应前后的质量差,由此计算出的实验结果比实际值偏低,排除仪器和操作的因素,其原因可能有:CO未完全反应、___________________________。
②称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,恰好反应完全。
(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)则KMnO4溶液显____________色,25.00g3.16%KMnO4溶液中KMnO4的质量____________g。样品中草酸晶体的质量分数为____________。
【Mr(H2C2O4)=90,Mr(H2C2O4•2H2O)=126,Mr(KMnO4)=158】。
一定条件下,CO与MgSO4反应会生成三种氧化物。某兴趣小组用如下装置探究该反应。
已知:SO2,CO2均能使澄清石灰水变浑浊,SO2能与高锰酸钾溶液反应,使高锰酸钾溶液裉色。
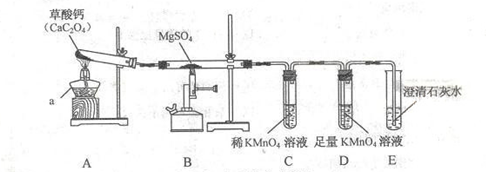
(1)装置A的作用是 。
(2)装置A中CaC2O4的分解会生成一种气体和一种相对分子质量为100的含钙的化合物,则A中反应的反应化学方程式为 。
(3)实验时观察到装置C中紫红色褪去,装置E中溶液变浑浊,则在C和E中反应的气体分别是 ﹑ ;
(4)装置B中反应的化学方程式是 ;
(5)装置D的作用是 ;
(6)实验结束,通过过滤、干燥等操作,兴趣小组同学测得装置E中的白色沉淀质量为2g(过程中损耗忽略不计),则E装置中吸收的二氧化碳质量至少是多少?
(7)该装置存在的明显不足之处是
某同学在实验室里制取CO2和验证CO2的某些性质,根据如图回答问题.
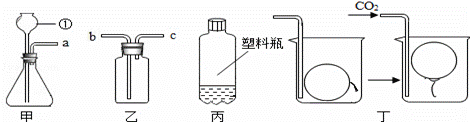
(1)写出图中仪器①的名称:______________;
(2)装置甲中应添加固体试剂的名称是____________,12.5g该固体(碳酸钙的质量分数为80%)最多可制得 g CO2气体;
(3)装置甲中发生反应的化学方程式为 _________________________ ;
(4)用装置乙收集CO2时,导管口a应与 _________ (填“b”或“c”)相连;
(5)用图丙所示的质地较软的塑料瓶收集满CO2,再倒入约1/3体积的紫色石蕊试液,立即旋紧瓶盖,振荡,观察到的现象① ② ;
(6)往图丁的烧杯内缓缓通入CO2,超薄材料做成的内充空气的气球会慢慢浮起,由此得出CO2具有的性质是 。
实验小组欲测定双氧水中过氧化氢的物质的量。
【设计原理】将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,再通过方程式计算,得到过氧化氢的量。(“碱石灰”是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽)
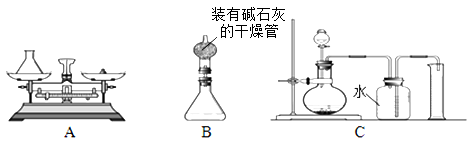
【过程方法】
(1)组长首先设计(如图A):向装有样品溶液的锥形瓶中投入二氧化锰,待双氧水完全反应完毕后测得产生氧气的质量是9.6g,则制取氧气为 (13) mol,双氧水中含过氧化氢多少mol?(写出具体计算过程) (14) 。
(2)小林对组长的设计提出质疑,在组长方案的锥形瓶上加一装有碱石灰的干燥管(如图B),然后再操 作,请说明小林质疑的理由是 (15) 。
(3)若用C装置来制取氧气并测得氧气的体积,此处的收集方法是 (16) 法,收集到氧气的体积约等于 (17) 。
小明测得石灰石与一定量的稀盐酸反应后的溶液PH为2,也适量该溶液向其中逐滴加入碳酸钠溶液,并测得溶液PH随加入碳酸钠溶液体积的变化曲线如下图所示。
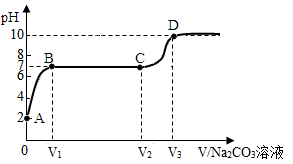
请回答下列问题:
(1)A点处溶液中的两种溶质是(写化学式);
(2)AB段可观察到的实验现象是 ;
(3)BC段发生反应的化学方程式是 ;
(4)CD段PH上升的原因是;
某氢氧化钙粉末中含有碳酸钙杂质.现取样品15g于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示。
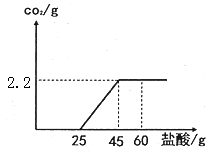
(1)生成二氧化碳的质量是g;
(2)加入60g稀盐酸后所得溶液中含有的溶质是、(填化学式);
(3)计算样品中碳酸钙的质量分数(写出计算过程,结果精确到0.1%).
"铁、锌、铜、镁、铝"是生活中常见的金属。请根据所学知识回答下列问题:
(1)铝块能制成铝箔是利用了铝的性;
(2)黄铜是铜锌合金,其硬度比纯铜(填"大"或"小")。
(3)将一定质量的锌粒投入含有
和
的混合溶液中,充分反应后过滤,若滤液中只含一种溶质,则滤渣中一定含有;
(4)将等质量的镁、铁、锌三种金属分别放入三份溶质质量分数相等的稀盐酸 中。生成氢气的质量与反应时间的关系如图所示。金属
是(填化学式,下同),反应后可能已经反应完的金属是,一定有剩余的金属是。

复习课上,老师要求学生用不同的方法鉴别稀硫酸和氢氧化钠溶液。小东、小南两位同学取同一溶液分别进行如下实验:
【实验方案】
| 实验步骤 |
实验现象 |
实验结论 |
|
| 小东 |
用玻璃棒蘸取溶液滴到pH试纸上,对照比色卡并读出pH |
pH试纸变色 pH7(填">"或"<") |
该溶液是氢氧化钠溶液 |
| 小南 |
取适量溶液于试管中,加入经打磨过的铝条 |
有气泡产生 |
该溶液是稀硫酸 |
【提出问题】为什么我们取相同溶液而实验结论却不同呢?
【解决问题】
小东、小南讨论后决定再用硫酸铜溶液进一步验证,结果观察到的现象是,于是一致认为该溶液是氢氧化钠溶液。为什么小南加入铝条会有气泡产生呢?通过查阅资料,他们发现初中常见金属中只有铝能与酸、碱反应,铝与氢氧化钠溶液反应的化学方程式是:
。
【拓展延伸】利用老师要求鉴别的那两种溶液,测定镁铝铜合金中各成分的含量。实验设计如下:

【回答问题】
(1)写出操作I中玻璃棒的作用:。
(2)a溶液是,选择该溶液的理由是。
(3)金属铜的质量为g,固体A含有的物质是,溶液A中所含溶质是。
铝是生活中常见的金属。
(1)金属铝常用做导线是利用它的 性;
(2)金属铝表面常有一层致密的氧化膜,氧化膜主要成分是 (填名称或化学式);
(3)资料显示:铝与氢氧化钠和水反应生成偏铝酸钠(NaAlO2)和氢气;用56.25g 含杂质4%的铝片(杂质对产生氢气的质量无影响)与足量的氢氧化钠和水充分反应,生成氢气的质量为 g。
金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是(填字母)
A.铂金饰品 B.铁锅 C.铝导线
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是(填 序号)
①将铝、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中
④将铜分别浸入到硫酸铝、硝酸银溶液中
(3)在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是(填化学式);
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是(填化学式)。
(4)某钢铁厂每天需消耗4900t含
76%的赤铁矿石,该厂理论上可日产含
98%的生铁的质量是t。
天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是 ;用肥皂水检验某自来水是硬水还是软水时,发生的化学反应之一为:
2C17 H35COONa+X= (C17H35 COO)2 Ca↓+2NaCI
则X的化学式是 ;漂白粉主要成分是Ca(ClO)2,是一种常见的泳池消毒剂,在Ca( ClO)2中氯元素的化合价为 。
我国首台使用二甲醚为燃料的城市客车有效地解决了公交车冒黑烟的问题。
(1)二甲醚的化学式为C2H6O,二甲醚由 种元素组成,属于 (填有机物或无机物),二甲醚的相对分子质量是 ,其中碳、氢元素质量比为 。
(2)二甲醚在空气中不完全燃烧生成二氧化碳、一氧化碳和水,请计算燃烧92g二甲醚生成水的质量为 克。
现有10%的
溶液,请按下面要求计算:
(1)106 g上述溶液中所含溶质量为g;
(2)106 g 上述溶液与足量10%的盐酸反应,最多可生成
多少克?
(3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为:
当
全部转化为
后,再加入盐酸才开始放出
。请在"题25图"中画出产生气体的曲线。

(4)另取10%
溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:
| 物质 |
|
|
H2O |
|||
| 质量/g |
31.8 |
14.6 |
16.8 |
23.4 |
4.4 |
m |
则m=;该反应的化学方程式为。
一定条件下用
捕捉
的反应为
,生成的三聚氰胺(
,相对分子质量为129)是重要的化工产品。请回答下列问题:
(1)三聚氰胺中
四种元素的质量之比为。
(2)每生产
三聚氰酸,可以捕捉
的质量为。
(3)
溶液同样能用于"捕捉"
,反应为
□,□中物质的化学式为。
金属及金属材料在生产生活中应用十分广泛。请回答以下问题:
(1)下列厨房用品所使用的主要材料,不属于金属材料的是________(填字母序号)。
(2)人类有多种从自然界中提取金属的方法。其中我国是世界上最早采用湿法冶金提取铜的国家,请写出铁与硫酸铜溶液反应制取铜的化学方程式_______ _。并求算用这种方法制取铜,11.67t含杂质4%的生铁完全反应,在理论上可以换取 t铜。
(3)金属钠性质很活泼,只能以化合物的形式存在于自然界,其中氯化钠就是一种常见且很重要的含钠化合物。氯化钠的用途十分广泛,化工生产中经常采用电解熔融氯化钠的方法制取金属钠(也就是在通电条件下使融化的氯化钠分解),试写出该反应的化学方程式 (注:该反应的另一种产物是由双原子分子构成的气态物质)。工业生产还可以通过电解食盐水的方法制取烧碱,与此同时产生的氢气和氯气可以合成其它重要的化工产品。请运用“化学语言”描述工业上用氯化钠制取烧碱的过程。 。
试题篮
()