氢氧化钠固体如果密封不严,会发生变质,为探究学校实验室内某瓶氢氧化钠固体
变质情况,化学兴趣小组进行了如下实验:
(1)取少量该瓶固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,该小组确定氢氧化钠已经变质,那么该小组同学加入的无色溶液可能是
(2)为了继续探究氢氧化钠的变质程度,该兴趣小组同学取了10g样品,溶于足量水配成溶液,然后向溶液中滴加含足量氢氧化钙的溶液,恰好得到1g沉淀和500g溶液,请计算出最后所得溶液中溶质的质量分数为多少?(计算结果精确至0.1%)
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如图1的实验装置。
图1
①实验装置乙中盛放的试剂为 ,
其作用是 ;
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你
认为他的理由是 ,应该将装置甲中双孔橡
胶塞换成三孔橡胶塞,并增加图2装置,实验结束后缓缓通入一段时间空气,
目的是 ,其中NaOH溶液的作用是 。
图2
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%,共3分)
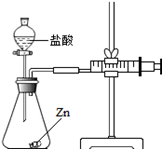
化学兴趣小组的同学对"影响金属与盐酸反应的剧烈程度的因素"进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有.
从实验现象可判断:金属活动性
(填"<""="">").
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是.
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是.所用药品,实验数据如下表:
| 实验编号 |
选用金属(均取2g) |
盐酸质量分数(均取50mL) |
每分钟产生氢气的体积/mL |
|||||
| 1分钟 |
1﹣2分钟 |
2﹣3分钟 |
3﹣4分钟 |
4﹣5分钟 |
前5分钟共收集气体 |
|||
| Ⅰ |
锌片 |
15% |
2.9 |
16.9 |
11.0 |
9.2 |
7.6 |
48.5 |
| Ⅱ |
锌片 |
5% |
1.6 |
8.4 |
5.9 |
4.8 |
3.7 |
24.4 |
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到
溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为 .
为探究酸碱盐之间的反应,小红同学做了以下实验:在稀硫酸中加入了一定量的硝酸钡溶液。请回答:
(1)观察到的实验现象是 ,反应的化学方程式为 ,分析实验现象,溶液中减少的离子是 (写离子符号)。
(2)小红同学在稀硫酸中加入硝酸钡溶液时,硝酸钡溶液可能过量,检验溶液中含有少量
硝酸钡的方法是 。
(3)在98g质量分数为10%的稀硫酸中加入100g硝酸钡溶液,恰好完全反应,所加硝酸钡溶液中溶质的质量分数是 (计算结果精确到0.1%)。
(4)若要配制98g质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸(密度为
1.84g/cm3) mL(计算结果精确到0.1)。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶,并贴上标签。
某化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究,查阅资料如下:
1、该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
2、牙膏中其它成分遇到盐酸无气体生成;
3、碱石灰的主要成分为生石灰和氢氧化钠固体。
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀的质量,以确定碳酸钙的质量分数。请回答下列问题: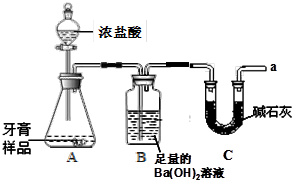
(1)B中反应生成BaCO3的化学方程式是 。
(2)C装置的作用是 。
(3)下列各项措施中,不能提高测定准确度的是 (填序号)。
| A.在加入盐酸之前,应排净装置内的CO2气体 |
| B.滴加盐酸不宜过快 |
| C.在A~B之间增添盛有浓硫酸的洗气装置 |
| D.在A~B之间增添盛有饱和碳酸氢钠溶液的洗气装置 |
(4)有同学认为该装置测定出来的碳酸钙质量分数会偏低,他的理由是
,解决方法是 。
(5)某同学认为不必测定B中生成的BaCO3质量,将B中的Ba(OH)2溶液换成浓H2SO4 ,通过测定C装置反应前后的质量差也可以测定CaCO3的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。请计算样品中碳酸钙的质量分数。(写出计算过程)
油条是人们喜欢的早点,中国油条的传统加工配方是用明矾(KAl(SO4)2)作为膨松剂,明矾常引起铝残留影响人体健康问题,现在的膨松剂常用臭粉(碳酸氢铵)、小苏打。
(1)油条中的主要营养素是油脂和
(2)“铝残留影响人体健康”中的铝是指 (选填“原子”或“元素”或“单质”)
(3)已知某膨松剂含碳酸氢铵、碳酸氢钠中的一种或两种,兴趣小组对该膨松剂进行如下探究:
【查阅资料】① 2NaHCO3 Na2CO3+H2O+CO2↑; NH4HCO3
Na2CO3+H2O+CO2↑; NH4HCO3  NH3↑+H2O+CO2↑。
NH3↑+H2O+CO2↑。
②氨气能使湿润的红色石蕊试纸变蓝。浓硫酸可用于吸收氨气。
③ 碱石灰是固体氢氧化钠和氧化钙的混合物,能作干燥剂,和二氧化碳反应,不与氨气反应。
实验I:探究膨松剂的成分
按下图所示连接好装置。
实验记录
| 实验操作 |
主要实验现象 |
实验结论 及解释 |
|
| ① |
检查装置的气密性 |
|
装置的气密性良好 |
| ② |
点燃酒精灯。 |
试管中白色固体减少,红色石蕊试纸 ,澄清石灰水变浑浊。 |
有二氧化碳和氨气生成 |
| ③ |
继续充分 加热 |
试管中仍有固体。 |
|
得出结论:该膨松剂的成分为 (写出化学式)。
实验II:探究产生气体的量
①测定二氧化碳的质量:如下图所示装置(气密性良好,各装置中的试剂为足量)。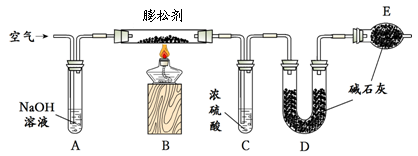
将8g膨松剂装入装置B中,加热前,先对已连接好的装置A、B和C通一段时间的空气,再连接装置D、E;加热过程中,装置C的作用是 ;停止加热后,继续通入一段时间的空气,目的是 。实验中,测定实验前后装置 (填字母序号)的质量,其质量差即为样品产生的二氧化碳气体的质量。若没有装置A,可能会造成测定结果 (填“偏大”、“不变”或“偏小”)。
②测定氨气的质量:将上图装置中 (填字母序号) 的连接顺序为对调。另取8g膨松剂装入装置B中,通过测定实验前后盛有浓硫酸的试管质量,其质量差即为样品产生的氨气的质量。若该装置的质量增加了1.36g,则同时共产生二氧化碳质量是多少? (有计算过程,结果精确到0.01)
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
、 的性质。
(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a: 、 b: 两个条件。
[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:1、在常温下Na2O2和CO2能发生化学反应。
2、无水硫酸铜为白色固体,吸水后变为蓝色。
[设计实验]:经过讨论后,小组同学设计了如下图2的实验进行探究。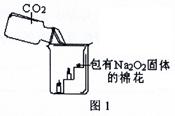
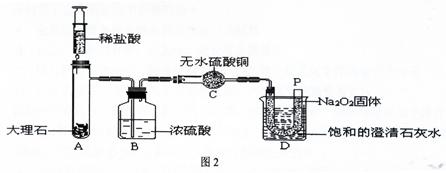
[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象。
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响。
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;③饱和的澄清石灰水变浑浊。
[实验分析]:①浓硫酸的作用是: 。
②D装置的烧杯内澄清石灰水变浑浊的原因是 。
[得出结论]:①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应将 能转化为热能,使图1中的棉花满足了燃烧的另一个条件。
[拓展提高]:①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,小明认为生成的固体是NaOH,小红认为是Na2CO3,同学们经过思考后认为 同学的猜想是错误的,理由是: 。
②Na2O2和CO2反应的化学方程式是 。
我国制碱工业先驱侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展作出了杰出的贡献。纯碱的用途非常广泛,某化学兴趣小组的同学对它产生了浓厚的兴趣,设计了如图两个实验,并对反应后试管中残留废液进行探究。
【实验1】往一支盛有碳酸钠溶液的试管中滴加无色酚酞溶液,观察到溶液变成 色。
【实验2】往另一支盛有碳酸钠溶液的试管中滴加稀盐酸,观察到的现象是 。同学们对实验2反应后的废液中溶质成分进行探究。
【提出问题】废液中所含溶质是什么?
【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl
猜想二:废液中的溶质可能是NaCl、Na2CO3
猜想三:废液中的溶质可能是
【设计实验】同学们为验证猜想,设计了如下实验:
方案一:
实验操作与现象 |
反应方程式 |
实验结论 |
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生 |
|
猜想二正确 |
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。
【进行讨论】同学们一致认为小明的实验结论不正确,理由是 。
【进行总结】分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑 。
【拓展与应用】现有14.9克纯碱样品(含Na2CO3和NaCl的混合物),将其放入干净的烧杯中,加入89.5克水使其完全溶解,向所得溶液中缓慢加入一定溶质质量分数的稀盐酸(反应方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O)。产生气体的质量与加入稀盐酸的质量关系如图所示,试回答下列问题:
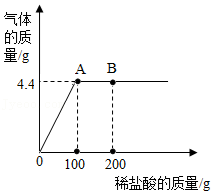
(1)产生CO2的质量为 克。
(2)所用稀盐酸中溶质的质量分数是多少? (写出具体的解题过程,下同)
(3)滴入稀盐酸至恰好完全反应时,所得溶液中溶质的质量分数是多少?

过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+ 4HCl → 4NaCl + 2CO2↑+ O2↑+ 2H2O
【实验装置】
【交流与讨论】
①甲同学认为测定产物中O2的体积即可测定样品的纯度。装置②的作用是:(15);装置③的作用是:(16);
②乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是;(17)(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
③丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,得到0.2mol氯化钠。则该样品的中过碳酸钠的质量分数为多少?(写出计算过程)
同学们对Na2CO3溶液也能使酚酞试液变红产生了兴趣。请你一同参与以下的实验探究。
【提出问题】碱溶液使酚酞试液变红,是因为碱在水中解离出OH﹣。Na2CO3属于 (选填“酸”、“碱”、“盐”);那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红呢?
【进行实验】同学们取了三份酚酞试液进行下图实验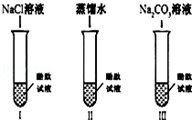
(1)实验I的目的是为了 ;
(2)实验Ⅱ加入蒸馏水的目的是探究水分子是否能使酚酞试液变红,小明同学认为实验Ⅱ没必要做,你认为小明的理由是 ;
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再滴加过量的CaCl2溶液,振荡,红色逐渐消失,同时观察到生成 。
【得出结论】溶液中的CO32﹣使酚酞试液变红;
【交流反思】(4)老师看了同学们的探究结论说:“Na2CO3溶液使酚酞变红也是由于溶液中存在OH﹣。”你认为Na2CO3溶液中存在OH﹣的原因可能是 。
【拓展应用】同学们称取10g纯碱(杂质只有氯化钠)固体,将其加入50g稀盐酸中,恰好完全反应,使气体全部放出(忽略CO2在水中的溶解),得到氯化钠溶液56.7g。请计算:①反应中产生的CO2的质量;②纯碱中Na2CO3的质量分数。(请写出解题过程)
化学是一门以实验为基础的科学,实验是科学探究的重要手段。
(1)完成“探究某种盐的性质”实验,填写下表。
试管序号 |
甲 |
乙 |
丙 |
实验操作 |
|
|
|
实验现象 |
红色溶液 |
白色沉淀 |
无色气体 |
实验结论 |
该盐是 (选填“NaCl”“Na2CO3”“Na2SO4”),其水溶液呈 性。 |
||
实验解释 |
丙中发生反应的化学方程式: 。 |
||
实验计算 |
全班同学完成试管乙实验,共消耗质量分数为10.4%的BaCl2溶液50g,实验后最多收集到 g白色沉淀。 |
||
(2)处理“CO2的实验室制取与检验”实验废液。全班同学完成该实验共产生1000g含HCl废液(固体已除,大理石中杂质未参加反应),不能直接排放。
【实验方案】先测定废液中HCl的质量分数,再用熟石灰处理废液至中性。
【实验操作】
①称量 g NaOH固体,溶解,配制30g 5%的NaOH溶液。
②取100mL小烧杯,倒入20g废液样品,插入pH计测定溶液的pH,向废液样品中逐滴加入5%的NaOH溶液。实验过程中溶液pH变化如图所示。
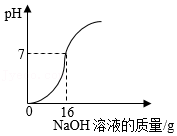
③投入 g熟石灰处理剩余废液(写出计算过程)。
【实验反思】有同学提出也可以根据盐酸具有挥发性直接加热废液除去杂质HCl,并得到CaCl2。写出你的观点及理由: 。
2014年12月28日,郑州地铁1号线投入试运营,不但缓解了市内交通压力,也改善了我市空气质量。
I.地铁站里氧气含量的测定
地铁站里氧气的含量应与地面保持一致。现有一瓶从地铁站里收集到的空气样品,康康利用如图实验装置测定样品中氧气的含量。请指出测定时需要注意的事项。(至少3条)
Ⅱ,铁的冶炼
地铁的修建需要大量的钢材。康康用下图装置模拟炼铁的化学原理,请写出反应的化学方程式: 。为了提高CO的利用率,你将怎样改进此装置?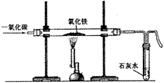
Ⅲ.金属材料在地铁方面的应用 在地铁修建过程中使用了大量的金属材料
(1)地铁入口处的雨篷骨架用铝合金而不用纯铁的原因是 。
(2)钢轨用锰钢的原因是 。
(3)出口处的广告架是金属经焊接而成的,焊条的熔点 (填“>”、“=”或“<”)组成焊条的纯属金属的熔点。
Ⅳ.金属的活动性
康康到工地了解了部分金属材料的防锈问题。技术人员告诉他,采用镀锌钢管做水管时,最好不要用铜质接头。为了探究这三种金属的活动性,康康把等表面积的铁片和锌片放入硫酸铜溶液中(如图所示)。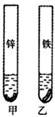
请回答:
(4)如何判断它们是否发生了化学反应?
(5)甲试管中反应前后溶液的质量(填“增重”、“不变”或“减轻”),乙试管中发生反应的化学方程式为 。
(6)上述实验不能够完全证明三种金属的活动性,需要补充的实验操作是 。
Ⅴ.郑州地铁1号线每车次运送乘客约1800人,走同样的路线,CNG公交车每车次消耗天然气akg(以甲烷计算),每辆CNG公交车运送乘客以60名计。若乘CNG公交车的乘客均改乘地铁1号线,则地铁每运行一车次,可减少二氧化碳排放多少千克?
将20g硫酸钠和氯化钠的混合物,加入到103.3g的氯化钡溶液中,完全反应后,过滤,所得到滤液的质量为100克.试计算:
(1)反应后生成白色沉淀质量为 g.
(2)原混合物中氯化钠的质量分数为多少?(写出计算过程)
某化学课外活动小组在实验室配制石灰水时,因发现烧杯底部有固体未溶解,对熟石灰样品的主要成分进行了探究。请你参与讨论并完成实验报告。
【提出问题】针对该熟石灰样品的成分,同学们展开了讨论,小明认为溶解后剩余固体为变质后的难溶性物质,变质的化学方程式为 。小华同学不同意他的判断,你认为小华同学的理由是 。
【进行猜想】猜想一:熟石灰样品成分是Ca(OH)2;
猜想二:熟石灰样品成分是CaCO3;
猜想三:你认为熟石灰样品成分还可能是 。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| ①取小烧杯中的物质进行 (填操作名称),得到固体和液体。 |
|
猜想三正确 |
| ②向①所得液体中加入适量 溶液; |
溶液变红 |
|
| ③向①所得固体中加入适量稀盐酸。 |
|
【拓展与应用】
(1)小组同学反思了熟石灰变质的原因,在初中化学我们所学过的物质中还有 (举一例)等也具有这样的性质,认识到这两种物质都应 保存。
(2)小明想测定样品中Ca(OH)2的质量分数,称取上述0.5g样品,加足量水使之充分溶解,搅拌过滤后,在实验室用pH试纸和配制好的10%盐酸溶液进行实验,实验数据记录见下表。
| 加入盐酸溶液的质量/g |
0 |
2.5 |
3.65 |
6 |
| 样品的pH |
12 |
11 |
7 |
2 |
①当pH=2时,溶液中所含的溶质是 (写化学式)。
②求样品中Ca(OH)2的质量分数。
金属材料在国防建设中起着量要的作用,图1为歼﹣15飞机在辽宁舰上起飞
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是 、 。
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的 共同作用的结果,工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为 。
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 。
②实验二中,若出现 现象,可证明铁的活动性强于铜,该反应的化学方程式为 。
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称量赤铁矿样品的质量为wg)。
①装置A中生成铁的化学方程式为 ,装置B中发生反应的化学方程式为 。
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是 。
试题篮
()