从物质的组成角度解释酸具有相似化学性质的原因是
| A.酸都含有酸根 | B.酸都能在水中电离出H+ |
| C.酸中都含有氢气 | D.酸中都含有氧元素 |
物质的性质决定其用途。下列物质的用途与性质对应关系错误的是
| A.氢氧化钙可用来改良酸性土壤——氢氧化钙溶液呈碱性 |
| B.固态二氧化碳可用于人工降雨——二氧化碳能溶于水 |
| C.氮气常用作保护气——氮气化学性质稳定 |
| D.氧化钙可做食品干燥剂——氧化钙能与水反应 |
下列化学方程式符合题意且书写正确的是
| A.正常雨水的pH约为5.6的原因:CO2+H2O=H2CO3 |
| B.医疗上用氢氧化镁中和过多胃酸:Mg(OH)2+HCl=MgCl2+H2O |
| C.工业上用高温煅烧石灰石的方法制生石灰:CaCO3高温 CaO+ H2O |
| D.证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl=2FeCl3+3H2↑ |
(11分)小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.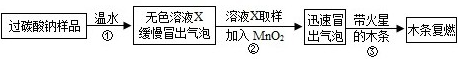
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.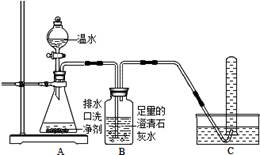
要保证实验的效果,实验装置要有良好的气密性,检查A装置气密性的方法是_________.实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是_______、________(填化学式).
【探究二】
(1)实验过程:教师提供了一瓶过碳酸钠(Na2CO4),
小组同学进行了如下实验探究:
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是 _____;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.写出上述实验探究中②反应的化学方程式__________.
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3+CaCl2═CaCO3↓+2NaCl
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
| 实验操作 |
主要实验现象 |
结论 |
| ①____________________ |
_____________ |
证明溶液中有Na2CO3 |
| ②_________________ |
______________ |
证明溶液中既无NaHCO3又无NaOH |
(6)实验反思:①根据资料,Na2CO4与水反应的化学方程式为________________.②Na2CO3、NaHCO3两种物质性质上既有共性又有差异,其差异性可用于鉴别、______等.
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式: 。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;
小亮认为:可能含有氢氧化钠和碳酸钠;小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
你认为还可能是 (写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中 的猜想不合理。
【实验设计】设计一个简单的实验证明你的猜想正确。 【反思拓展】
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑 。
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道 。
下列离子能在pH=13的水溶液中大量共存的是
| A.Cl-、SO42-、Ag+、Na+ | B.K+、Ba2+、N03-、SO42- |
| C.SO42-、Cl-、Na+、H+ | D.Ca2+、Na+、Cl-、OH- |
2014年眉山市化学实验基本操作考试中,有一题目是鉴别澄清石灰水和氢氧化钠溶液.请你参与探究:
【提出问题】如何鉴别这两种无色溶液?
【实验方案】小琪等几位同学进行了如图所示的实验.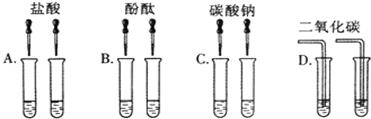
请你回答下列问题:
(1)C组实验中反应的化学方程式为 ___ ;
(2)其中不能达到实验目的是________ _(填字母);
(3)D组实验中变浑浊的原溶液是________ _ .
【继续探究】实验结束后,小琪同学将A、B、C、D四组试管中的物质全部倒入同一个干净的烧杯中,充分反应后,得到无色澄清透明的溶液,对该溶液的成分又进行了探究.
【提出问题】该溶液中除水、酚酞外还含有哪些物质?
【查阅资料】氯化钙溶液呈中性.
【猜想与假设】
Ⅰ. Ⅱ.NaCl、CaCl2、HCl Ⅲ.NaCl、CaCl2、NaOH
【反思与拓展】①上述猜想与假设中只有一个不成立,它是________ (填序号),理由是 __ .
②根据所学化学知识,验证烧杯内溶液中可能有的物质是否存在,下列哪些物质单独使用不能完成该实验
_________ (填字母)
a.pH试纸 b.硝酸银溶液 c.紫色石蕊试液 d.铜
有一包白色粉末可能是由NH4Cl、Na2CO3、BaCl2、NaCl、CuSO4中的一种或几种组成,为取得其组成。小东做了如下实验:
取少量白色粉末与研钵中,加入少量熟石灰混合碾磨,没闻到氨味;另取少量白色粉末加入到足量水中,出现白色沉淀,静置后上层溶液无色;倒掉上层溶液,向沉淀中加入稀盐酸,白色沉淀完全溶解,且有无色气体产生。
由此推断:该白色粉末中一定有: ,一定没有: ,可能有: 。
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为: ,待铁锈消失后又看到 的现象.
(1)根据下列图文回答问题: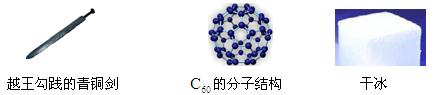
①青铜剑属于 (填“纯金属”或“合金”)。
②C60分子是由 构成的(添“分子”“原子”或“离子”)。
③干冰可用于 (填一例)。
(2)根据下图中自制汽水的配料回答问题。
①柠檬酸的pH 7(填“<”、“=”或“>”),能使紫色石蕊溶液变为 色。
②配料中柠檬酸的主要作用除了调味以外,从化学反应的角度分析,它还有一个重要的作用是 ;
(3)下列厨房用品所使用的主要材料,属于金属材料的是 ;
(4)化石燃料在燃烧过程中会产生各种废气(见下图),其中形成酸雨的主要气体是 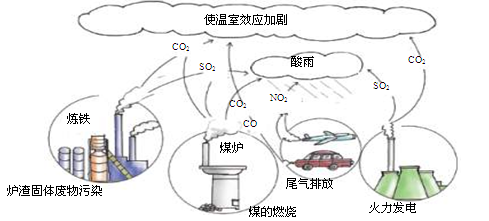
| A.SO2、CO2 | B.SO2、NO2 | C.CO2、CO | D.NO2、CO |
将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示。下列说法中正确的是
| A.N 点时,所得溶液的pH=7 |
| B.O至P段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O |
| C.Q点时,所得溶液中的溶质只含有BaCl2 |
| D.P至Q段发生反应是Ba(OH)2+2HCl=BaCl2+2H2O |
下列物质敞放在空气中一段时间后,因变质而质量增加的是
| A.浓硫酸 | B.氯化钠 | C.浓盐酸 | D.氢氧化钠 |
某兴趣小组的同学对一包在空气中敞口放置了一段时间的碱石灰产生了好奇,于是他们对这包碱石灰的成分展开了探究。
【提出问题 】他们要探究的问题是 。
【查阅资料 】①碱石灰是由CaO和NaOH固体混合而成,通常用于吸收二氧化碳及干燥气体。②熟石灰固体溶解度小,溶于水放出的热量少,可以忽略不计。
【提出猜想 】该碱石灰的主要成分可能含有CaO、NaOH、Ca(OH)2、CaCO3和 。
【实验探究 】小组的同学设计实验并进行验证,过程如下:
①小明取部分该碱石灰样品于试管中,加少量水后无放热现象,说明这包碱石灰样品中不含 。继续加足量水,振荡,静置后有白色沉淀,小明认为碱石灰样品中一定含有CaCO3,小美认为他的结论不准确,原因是 。
②从小明的试管中取少量上层清液于另一试管中,向其中滴加过量BaCl2溶液,有白色沉淀生成。
③把过程②所得物质过滤,向滤液中滴加无色酚酞溶液,溶液变红色。
【解释与结论 】根据以上探究:
①你认为该包碱石灰样品一定含有的物质是 ,可能含有的物质是 。
②实验探究过程③所得溶液中除酚酞外还含有的溶质是 。
【迁移应用】下列气体①氢气 ②氧气 ③一氧化碳 ④氯化氢 ⑤二氧化硫 ⑥氨气,不能用碱石灰干燥的是 (填字母序号)。
| A.①②③ | B.④⑤⑥ | C.④⑤ | D.⑤⑥ |
试题篮
()