某沿海工业区排放的污水中含有少量的
,
,
,
,
,为了达到零污染的目标,将污水进行如下工业流程处理:

(1)步骤Ⅰ的操作名称是,并写出步骤Ⅰ中的化学方程式.
(2)滤渣Ⅰ所含的物质是(填化学式).
(3)加入过量
溶液的目的是.
(4)在滤液Ⅲ中加入盐酸使得到的溶液呈中性,要使用来测定溶液的酸碱度,确保盐酸不过量.
研究小组进行木炭还原氧化铁的探究活动。将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨。取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失)。

【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁。铁的氧化物及其部分性质如下: 为红色固体;
为红色固体; 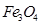 和
和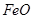 均为黑色固体。其中,
均为黑色固体。其中,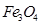 具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl ══ 2FeCl3+3H₂O
Fe3O4+8HCl ══ 2FeCl3+FeCl2+4H2O
FeO+2HCl ══ FeCl2 + H2O
黄色的 溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验
溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验 ;
; 溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
【猜想】固体X可能含有:①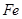 ②
②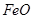 ③
③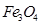 ④⑤
④⑤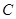
【实施实验】
目的:确定固体X的组成。
| 步骤 |
操作 |
主要现象 |
结论 |
| I |
取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引。 |
部分固体被吸引到磁铁上 |
可能有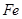 或 或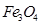 |
| II |
取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热。 |
固体剧烈燃烧, b中溶液变浑浊 |
一定有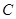 |
| III |
另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸。 |
无明显现象 |
一定没有 |
| IV |
取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸。 |
产生。 |
一定有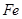 |
| V |
在步骤IV所得溶液中逐滴加入。 |
溶液不变红色 |
一定没有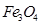 |
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有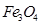 ,理由是。
,理由是。
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 |
操作 |
数据 |
| I |
重新取部分冷却至室温的固体X,称量其质量为m1。 |
m1 =" 17.9" g |
| II |
将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3。 |
m2 =" 317.9" g m3 = 317.3.g |
| III |
将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4。 |
m4 =" 1.1" g |
【获得结论】
(1)为确定固体X中是否含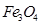 ,m1~m4中应该用到的数据有。
,m1~m4中应该用到的数据有。
(2)固体X的成分及质量分别是。
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为________________________________;
【查阅资料】
碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量样品溶于水,加入 ; |
白色沉淀产生 |
该反应的化学方程式为 |
| (2)将上述反应后的混合液过滤,取滤液加入 ; |
|
证明猜想Ⅱ成立。 |
下列图像不能正确反映其对应变化关系的是()
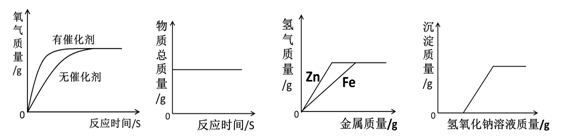
A B C D
| A. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 |
| B. | 一定质量的红磷在密闭容器中燃烧 |
| C. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 |
| D. | 向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
三种酸分别与足量的金属镁充分反应,生成等质量的氢气,反应消耗 的分子数目之比为3:6:2。下列关于 的推断合理的是( 、 、 分别表示三种酸
| A. | 三种酸溶液中 的原子数目: |
| B. | 与金属镁反应的速率: |
| C. | 的相对分子质量: |
| D. | 可能分别为 、 、 |
某同学做了如下图所示的实验,在14.6%的稀盐酸中加入碳酸钙,后加入10.6%的碳酸钠溶液
| |
第一次 |
第二次 |
| 14.6%的稀盐酸的质量 |
m |
m |
| 加入碳酸钙的质量 |
10g |
20g |
| 加入10.6%的碳酸钠溶液的质量 |
100g |
200g |
| 加入碳酸钠溶液后,实验现象 |
只有气泡 |
只有白色沉淀 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题
写出实验一中发生化学反应的方程式
第一次实验中加入碳酸钙后溶液中溶质成分
根据已知条件列出求解第二次实验生成沉淀的质量的比例式
实验中加入稀盐酸m的质量为
若将第二次反应后的溶液蒸发191.2g水,则所得不饱和溶液中溶质的质量分数为
若用溶质质量分数29.2%的浓盐酸配置实验所需的稀盐酸,则需要加水的质量
在一次用餐中,同学们对燃料“固体酒精”产生了好奇,于是对其成分进行研究。
【查阅资料】该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
【提出问题】固体酒精中的氢氧化钠是否变质?
【实验探究】
(1)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀。取沉淀与试管中加稀盐酸,有气泡产生。写出白色沉淀产生气体的化学方程式_______________。
分析实验并结合资料得出氢氧化钠已变质。
为进一步确定氢氧化钠的变质程度,分组探究。
(2)甲组取烧杯上层清液于两支试管中,按下图探究。
(3)乙组认为甲组实验不能证明清夜中一定有氢氧化钠,理由是________________。他们另取烧杯中上层清夜,加足量氯化钡溶液,充分反应后滴加酚酞溶液,酚酞溶液变红。
【实验结论】经讨论一致认为固体酒精中的氢氧化钠部分变质。
(4)【反思与评价】乙组实验中加足量氯化钡溶液的目的是________________。
(5)【拓展应用】要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的________。
A.Ba(OH)2溶液 B.CaCl2溶液 C.Ca(OH)2溶液
(6)【表达与交流】固体氢氧化钠在空气中易________,因此氢氧化钠固体必须密封保存。
某固体混合物由Na2SO4、Na2CO3、CaCl2、CuSO4、NaCl中的几种物质组成,为确定它的组成,做如下实验:
⑴取固体样品溶于水,振荡后得无色溶液;
⑵取部分此溶液加入BaCl2溶液,有白色沉淀生成;
⑶过滤,然后在白色沉淀中加入足量稀硝酸,沉淀最后全部溶解。
由此推断:原混合物中肯定有_________,肯定没有_______,可能有________________。
如果进一步确定可能有的物质是否存在,可取⑴得到的溶液滴加 溶液来检验。
(11分)小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.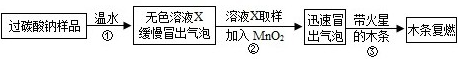
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.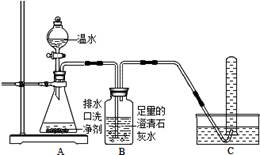
要保证实验的效果,实验装置要有良好的气密性,检查A装置气密性的方法是_________.实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是_______、________(填化学式).
【探究二】
(1)实验过程:教师提供了一瓶过碳酸钠(Na2CO4),
小组同学进行了如下实验探究:
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是 _____;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.写出上述实验探究中②反应的化学方程式__________.
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3+CaCl2═CaCO3↓+2NaCl
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
| 实验操作 |
主要实验现象 |
结论 |
| ①____________________ |
_____________ |
证明溶液中有Na2CO3 |
| ②_________________ |
______________ |
证明溶液中既无NaHCO3又无NaOH |
(6)实验反思:①根据资料,Na2CO4与水反应的化学方程式为________________.②Na2CO3、NaHCO3两种物质性质上既有共性又有差异,其差异性可用于鉴别、______等.
有A~F六种无色的液体,其中E溶液有咸味,其溶质可作为调味品,其余分别是稀盐酸、碳酸钠溶液、氢氧化钠溶液、氢氧化钙溶液、水中的某一种,请根据下面实验现象回答问题。
(1)将少量A分别滴入适量的B、C、D、F中,均没有明显现象。
(2)将少量B分别滴入适量的A、C、D、F中,C中有气泡出现,其余均没有明显现象。
(3)将少量D分别滴入适量的A、B、C、F中,均没有明显现象。
①溶液E中的溶质是 。
②写出B滴入C中发生反应的化学方程式 。
③根据实验现象能判断出的:B是 C是 F是
④对还没有确定的溶液(或液体),下列几种鉴别方法中,正确的是 (填序号)。
A.分别滴加硫酸铜溶液 B.分别滴加澄清石灰水
C.分别滴加石蕊溶液 D.分别滴加稀盐酸
6分)实验小组对久置生石灰的成分进行分析,实验操作及部分现象如下图所示。
【资料:Na2CO3+CaCl2 =" 2NaCl" + CaCO3↓】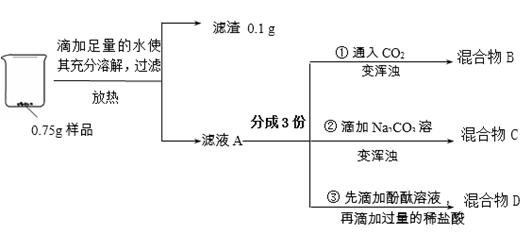
回答下列问题:
(1)样品加水放热的原因是 (用化学方程式表示)。
(2)②中反应的化学方程式是 。
(3)③中的实验现象是 。
(4)将混合物B、C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。向滤液E中滴加CaCl2溶液,有白色沉淀生成,则滤液E中的溶质可能是 。
依据实验现象及数据判断,原样品的成分是 。
以下是我们日常生活中常用各种清洗剂。
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
活氧彩漂 |
污渍爆炸盐 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过氧化氢 |
过碳酸钠 |
(1)我们使用洗涤灵清洗餐具上的油污,这是因为它具有 的功能。
(2)清除以下物质,可以使用洁厕灵的是 填字母序号)。
A.铁锈 B.水垢(主要成分为碳酸钙和氢氧化镁)
C.油渍 D.氢气还原氧化铜实验后,试管内壁残留的红色固体
(3)“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,这一反应了体现右图中 (选填①②③④)性质关系。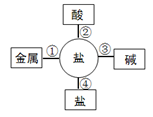
(4)将洁厕灵滴入炉具清洁剂中,如图甲所示。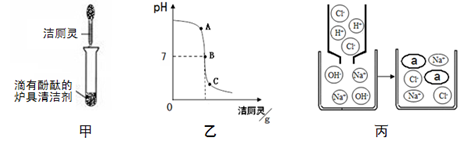
①若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外) ;此时溶液可用图乙中 点处(选填A、B、C)表示。
②若反应后溶液pH为7,图丙中a微粒的化学式为 。
(5)①“活氧彩漂”可用于漂洗衣物、杀菌消毒等,原因是其有效成分过氧化氢分子中含有“过氧基”(—O—O—)。据此推测,下列物质中,可用作杀菌消毒剂的是 (填序号)。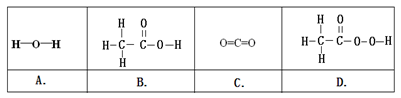
②氧化氢溶液常用于医用消毒,某兴趣小组为测定一瓶久置的医用过氧化氢溶液中溶质质量分数。他们取该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示。试计算该过氧化氢溶液中溶质的质量分数。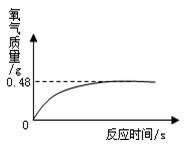
(写出计算过程)
在实验室,某同学将氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量.加入氢氧化钠溶液的质量(横轴)与混合溶液中溶质质量(纵轴)的关系如图所示.
(1)实验中,观察到的现象为.
(2)实验中发生反应的化学方程式有.
(3)图中
线段对应溶质质量减小的本质原因是.
(4)向反应后的溶液中加入适量
溶液,恰好完全反应后溶液中的溶质有.

除去以下物质中的少量杂质,所用试剂及方法正确的是
| 选项 |
物质 |
杂质 |
所用试剂及方法 |
| A |
|
通入足量的
溶液 |
|
| B |
溶液 |
稀盐酸 |
加入过量的
,过滤 |
| C |
溶液 |
溶液 |
加入足量的
粉,过滤 |
| D |
溶液 |
溶液 |
加入适量的
溶液,过滤 |
试题篮
()