有一瓶标签破损的稀硫酸,为测定其溶质质量分数,取出
溶液,加入足量的锌粒。充分反应后,产生的氢气为
。

①计算
溶液中
的物质的量(根据化学方程式列式计算)
②计算并在新标签的横线上填写该溶液的溶质质量分数。
对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示。(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2=BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
化学兴趣小组的同学在实验室测定某赤铁矿石中氧化铁的质量分数。取赤铁矿石样品10.0 g,加入稀盐酸109.5 g,恰好完全反应。过滤得到滤渣2.0 g(假设杂质既不溶于水也不与酸发生反应)。请计算:
(1)赤铁矿石中氧化铁的质量分数;
(2)反应后所得溶液中溶质的质量分数。
(计算结果精确到0.1%,写出必要的计算过程。可能用到得相对原子质量:H—1,C—12,O—16,Cl—35.5, Fe—56)
为测定铜锌合金的组成,某化学小组的同学将200克稀硫酸分四次加入到40克合金中,得出如下数据和图像。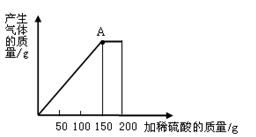
请计算:
(1)a的数值为 。
(2)合金中铜的质量分数为 。
(3)实验所用稀硫酸的质量分数是 。
超氧化钾能与二氧化碳反应生成氧气(4KO2+2CO2=2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供养剂。要得到320克氧气,参加反应的超氧化钾的质量是多少?
(6分)烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8 g。某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线。
实验室常用锌块和稀硫酸反应制取氢气,若用6.5克锌和稀硫酸完全反应。则:
(1)可制取多少克氢气?
(2)理论上需要质量分数为19.6﹪的稀硫酸溶液多少克?
某校兴趣小组探究学校附近赤铁矿中Fe2O3的纯度。他们采集了80g矿样,粉碎后均分成四等份,分别置于四个烧杯中,然后分别向四个烧杯中加入同一浓度的稀硫酸,加入硫酸的质量与反应后剩余固体质量如下表所示。(假设矿石中的杂质既不和稀硫酸反应,也不溶于水)求:
| |
实验1 |
实验2 |
实验3 |
实验4 |
| 加稀硫酸质量 |
150g |
240g |
330g |
400g |
| 剩余固体质量 |
12g |
7.2g |
4g |
4g |
(1)该矿样中Fe2O3的质量分数。
(2)所用稀硫酸的溶质质量分数。
为了测定某赤铁矿石中氧化铁的质量分数,取矿石样品40g,加入盐酸,恰好完全反应时,共用去盐酸219g,过滤、洗涤、干燥后得滤渣8g(矿石中的杂质既不溶于水也不与盐酸反应)。计算:
(1);
(2)盐酸的溶质质量分数
小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
| 序号 |
加入稀盐酸质量(g) |
剩余固体质量(g) |
| 第1次 |
10 |
5.5 |
| 第2次 |
10 |
m |
| 第3次 |
10 |
1.2 |
| 第4次 |
10 |
1.2 |
(1)8 g的石灰石样品中含有杂质多少克?
(2)样品中碳酸钙的质量分数是多少?
(3)上表中m的数值应为多少?
(4)要得到280 kg的CaO,需要质量分数为80%的石灰石多少千克?
实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5 g,加入1g MnO2,完全反应后称得剩余物的质量为41.9 g。计算:
(1)反应中放出氧气的质量
(2)实验中参加反应的过氧化氢的质量
计算下列物质的相对分子质量或相对分子质量之和
⑴氯气(Cl2)
⑵二氧化锰(MnO2)
⑶碱式碳酸铜[Ca(OH)2]
⑷2CO2的相对分子质量之和
实验室里现有一包氯化镁和氯化钠的固体混合物样品,某同学取该样品12.8
,使之完全溶解在50
水中,再向其中加入40
%的氢氧化钠溶液,恰好完全反应.求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中氯化镁的质量.
(2)反应后所得溶液中氯化钠的质量分数.
试题篮
()