如图是某同学配制50g溶质质量分数为15%的KNO3溶液的过程:
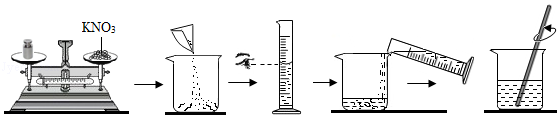
回答下列问题:
(1)配制溶液的步骤是:计算、 、量取、溶解、装瓶贴标签。
(2)指出图中的错误: ,若其他操作均正确,该操作会导致最终配制的溶液溶质质量分数 (“偏大”或“偏小”)。
(3)量取水时,应选择 (填“10mL”、“50mL”或“100mL”)的量筒,量取过程中,还需要的一种仪器是 。
(4)实验中发现硝酸钾已结块,为了较快地溶解,合理的方法有 (填数字序号)。
①将硝酸钾研碎 ②用热水溶解 ③加入更多的水 ④用玻璃棒搅拌
根据所学知识,结合下列仪器,回答有关问题.

(1)写出仪器的名称:C ;E .
(2)实验室以大理石和稀盐酸为原料制取二氧化碳,反应的化学方程式为 ;收集二氧化碳采用的方法是 ;若采用H装置作为气体的发生装置,其突出的优点是 .
(3)实验室用高锰酸钾制取并收集纯净的氧气,需要选择上述仪器中的 (填字母序号),此外还需增加的仪器是 ,反应的化学方程式为 .
(4)若采用Ⅰ装置收集氧气,验满的操作是 .
有一包白色粉末,可能含有硫酸铜、氯化钠、氯化钡、硫酸钠中的一种或几种物质,实验小组设计如下实验方案,探究白色粉末的成分

请回答:
(1)操作a的名称: 白色沉淀A的化学式 .
(2)由步骤1的现象判断,原白色粉末一定不含 .
(3)无色溶液b中溶质的成分是 .
(4)由以上实验可知,原白色粉末一定含有 .
从化学的角度分析解释下列问题
(1)吸烟有害健康,非吸烟者也会造成被动吸烟,用分子的观点解释 .
(2)一支烟头会引发一场火灾,从燃烧的条件上讲,烟头的作用是 .
(3)用碳素墨水填写重要的档案,时间长久不褪色 .
(4)在铁制品表面刷漆,涂油能防止铁生锈,原理是 .
金属是重要的资源,与我们的生活息息相关.
(1)古人将黄金拉成极细的丝,压成薄片,制成装饰品,是利用金具有良好的 性.
(2)生铁和钢制品在生活中应用广泛,由于 不同,生铁和钢的性能也有所不同.
(3)将一定量的铁粉加入到含有MgCl2、CuCl2的废液中,反应后过滤.
①若向滤渣中加入稀盐酸没有气泡产生,则滤出的固体是
②若向滤渣中加入稀盐酸有气泡产生,则滤液中溶质的成分是 .
合理利用能源和保护环境是我们关注的问题.
(1)煤燃烧产生的 排放到空气中会引起酸雨,请写出一条酸雨的危害: .为了减少对环境的污染,人们正在利用和开发其他能源,如 (填一种)
(2)近日,“共享单车”入驻盘锦,骑自行车出现是一种低碳生活方式,可以减少 (填物质)的排放
(3)科学家发现海底埋藏着大量的“可燃冰”,已知可燃冰主要含甲烷水合物,写出甲烷燃烧的化学方程式 .
现有一包铝和氧化铝的混合物,向其中加入足量稀硫酸充分反应,生成0.3g氢气。
(1)铝与稀硫酸反应生成硫酸铝和氢气。根据化学方程式计算原混合物中铝的质量。
(2)反应后测得溶液中有34.2g硫酸铝。计算原混合物的质量。
如图所示,某活动小组为验证氢氧化钠和氢氧化钙的性质,设计并进行以下实验(装置气密性良好):分别打开分液漏斗活塞,将等体积的氢氧化钠饱和溶液和氢氧化钙饱和溶液全部加入锥形瓶中,关闭活塞,打开弹簧夹K1、K2,观察实验现象。

(1)B中的短导管可使集气瓶内外的气压保持一致,这样设计的目的是什么?
(2)以上实验证明氢氧化钠、氢氧化钙能与二氧化碳反应,根据哪些现象能判断出氢氧化钠与二氧化碳确实发生了反应?该实验还能验证氢氧化钠和氢氧化钙的什么性质?
(3)实验后,从A中锥形瓶内取出适量溶液,倒入试管中,设计实验证明该溶液中含有氢氧化钠,写出实验操作及现象。
三名同学为验证铝、铁、铜、银四种金属的活动性顺序,分别设计方案,所用试剂如下:
甲同学:铜丝、银丝、硫酸铝溶液、硫酸亚铁溶液
乙同学:铝丝、铁丝、银丝、稀盐酸、硫酸铜溶液
丙同学:铝丝、铜丝、硝酸亚铁溶液、硝酸银溶液
(1)甲同学的方案不能达到实验目的,说明原因。
(2)乙同学要用稀盐酸验证铝、铁的金属活动性顺序,写出实验操作及现象。
丙同学观察到实验现象后,将废液倒入同一烧杯中,向其中加入一定量的铁粉,充分反应后过滤,滤渣中一定有 。滤液中一定有的溶质是 。
在实验室常用以下装置制取气体。

(1)选择装置A用高锰酸钾制取氧气的化学方程式为 ,选择发生装置的依据是 。
(2)选择装置B制取氧气的化学方程式为 ,收集气体采用的是 法。
(3)用装置B制取二氧化碳的化学方程式为 ,实验过程中,长颈漏斗的末端应保持在 。
运用所学知识,分析下列事实中的原理。
(1)干草易点燃,湿草不易点燃。
(2)将干草卷成紧实的粗条状,外面用一层湿草紧紧包裹,在一端点燃干草后,将火焰吹熄,使干草保持红热状态,这样可使火种保持较长时间。
如图所示,集气瓶I、II 中分别装有二氧化碳和氧气,把中间的玻璃片抽出,一分钟后,取下集气瓶I,将燃着的木条伸入集气瓶II 中,木条熄灭,用微粒的观点解释现象。

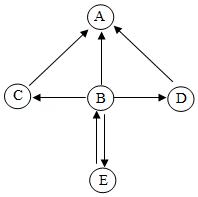
A、B、C、D、E是初中化学常见的物质。其中A、B、E均为氧化物,且B、E组成元素相同,C、D为不同类别的化合物,D在工业上广泛用于玻璃、造纸、纺织和洗涤剂的生产等。它们的转化关系如图所示(“→”表示物质间转化关系,部分反应物、生成物及反应条件已略去)。请回答:
(1)C的化学式是 ,B的一种用途: 。
(2)B→E反应过程中会 (填“吸收”或“放出”)热量。
(3)写出B→A反应的化学方程式 。
阅读下列科普短文,回答下列问题.
生活中,我们常常能品尝到酸酸的食物,比如柠檬、酸奶…,因此,人们常认为有酸味的物质就是酸.但是,这种判断方法是错误的,在化学世界里,“酸”是在水中解离出的阳离子全部为H+的化合物,而“碱”是在水中解离出的阴离子全部为OH﹣的化合物,二者一见面,就会“水火不容”﹣﹣结合成水.
我们平时吃柠檬、苹果的时候感觉到酸酸的,那它们是酸性食物吗?答案:不是.因为判断食物的酸碱性,是根据食物进入人体后生成的最终代谢物的酸碱性而定.例如,酸性食物有肉、蛋、鱼、油脂、糖类等;碱性食物有蔬菜、茶叶、水果(高糖水果除外)、豆制品、牛奶等.
(1)下列物质属于酸的是 .
A.硫酸 B.碳酸氢钠 C.醋酸
(2)请写出有氯化钠生成的中和反应的化学方程式 .
(3)研究发现,多吃碱性食物有益健康.判断食物的酸碱性的依据是 .
A.人体的味觉
B.食物溶于水中的酸碱性
C.食物在体内最终代谢物的酸碱性.
试题篮
()