2017年5月18日,中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变.可燃冰是在高压低温环境条件下,水分子笼中装有甲烷分子而成的“冰块”,可直接点燃.已知某种可燃冰的化学式为:CH4•8H2O.请回答:
(1)这种可燃冰中含有 种元素:原子个数比:C:H:O= ;
(2)这种可燃冰中甲烷的质量分数为 %;936g(约1升)该可燃冰常温下可释放出 升甲烷(常温下甲烷密度为0.72g/L).
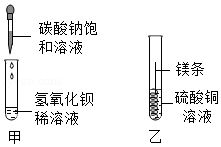
某同学进行如图两个实验:
(l)甲实验中反应的化学方程式为 ;
(2)乙实验观察到的现象是 ,溶液由蓝色变成无色
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
[查阅资料]硫酸钡不溶于酸。
[提出猜想]白色沉淀为:Ⅰ. ;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3。
[实验方案]
实验操作 |
实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 |
①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为 。 ②若 且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解, ,猜想Ⅲ成立。 |
[拓展与思考]如果猜想Ⅲ成立,产生此结果的原因是做甲实验时 ;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是 。
根据如图回答有关问题。

(1)仪器a的名称是 ;图中可用于加热KClO3制备O2的装置为 (填序号),化学反应方程式为 。
(2)若用铁片与稀盐酸在A装置中制备H2,铁片应放在 ;用F收集H2时导入气体的导管端为 (填“b”或“c”);检验装置D气密性的方法是:用止水夹夹紧导管口的橡胶管后, ,则气密性良好。
(3)图中可用于固液反应制备气体的装置中,不能使反应随时发生或停止的装置是 (填序号),原因是反应过程中若用止水夹夹紧橡胶管后, 。
(4)若用过氧化氢溶液制备O2,最好选用装置 (填序号),把F装满水,用排水法收集O2并测定气体体积,应在 端(填“b”或“c”)连接上一个量筒。
某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见如图:
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:
(1)石灰浆吸收SO2(性质与CO2相似)的化学反应方程式为 。
(2)溶解步骤中同时发生的三个化学反应方程式为:Fe+Fe2(SO4)3═3FeSO4、 、 。
(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、 、过滤,得到FeSO4晶体,其中氮气的作用是 。
(4)政府倡导垃圾分类,其好处是(写一点): 。
A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质(如图所示。箭头表示物质间能转化,实线表示物质间能反应)。请回答:
(1)若B常温下为固态。则B是 ,F的化学式为 。
(2)若B常温下为气态,则A是 。
(3)G+H反应的化学方程式为 ; 此反应属 反应(填反应类型)。

我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为 。应选择的气体收集装置为 (选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) CaCl2+2H2O+2NH3↑.现要制备并干燥NH3,所选装置的正确连接顺序为 → (选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式 。
II.NaHCO3制备
物质 |
NaHCO3 |
NH4Cl |
溶解度/g(20℃) |
9.6 |
37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因 。
(4)该过程中另一产物NH4Cl在农业生产中常被用作 。
甲、乙、丙是初中化学常见物质.这些物质之间的转化关系如下图所示.

根据以上信息,请回答下列问题.
(1)写出甲的化学式 .
(2)写出反应①的化学方程式 .
(3)写出反应②的化学方程式 .该反应属于 反应(填基本反应类型).
(4)反应③在一定温度下进行,若乙为Fe2O3,则丙为Fe;若丙为Cu,则乙为 (填化学式).
(5)请完成下列表格,证明Fe的金属活动性比Cu的强.
实验方案 |
实验现象 |
将铁片浸入 (填化学式)溶液中 |
铁片表面析出 固体 |
某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2。
(1)配制100g 10%稀盐酸需要37%浓盐酸(密度1.19g/cm3)的体积为 mL(结果保留小数点后一位)。除了胶头滴管、烧杯外还需要的玻璃仪器是 、 。
(2)6.5g粗锌完全反应共产生H2的质量为0.16g,则该粗锌中锌的质量分数为 。
(3)验证后用装满水的10mL量筒代替小试管收集H2,装置如图所示。
①10mL量筒的最大刻度靠近 端。(填写“M”或“N”)
②当10mL量筒中的水全部被排尽后,实际收集到的H2体积V 10.0mL.(填写“>”、“=”或“<”)

分液漏斗是化学实验室一种常用的仪器,可用于滴加液体或分离互不相溶的两种液体,实验室部分装置如A~D所示.
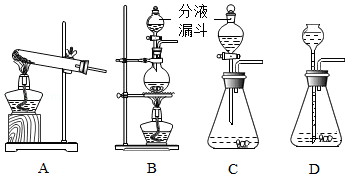
(1)实验室用KMnO4制取O2的化学方程式为 .
(2)实验室制取气体通过反应物状态,反应条件等选用相应的反应装置,请完成下表空格.
制取的气体 |
反应物 |
反应条件 |
反应装置(填字母) |
O2 |
KClO3固体 |
催化剂MnO2固体、加热 |
|
|
H2O2溶液 |
催化剂MnO2固体、常温 |
C或D |
CO2 |
和 |
常温 |
|
N2 |
NH4Cl饱和溶液与NaNO2饱和溶液 |
加热 |
|
(3)关于装置C和D的下列说法正确的是 .(双项选择)
A.装置C发生反应时,分液漏斗下端必须浸没在液体中.
B.装置D发生反应时,长颈漏斗下端必须浸没在液体中
C.装置C和D的气密性检查的操作方法相同
D.装置C和D均可用于制取一定量的H2.
如图所示装置。

(1)仪器名称:X ;Y 。
(2)A是蒸馏装置。在X中加入约 体积的硬水,再加入几片碎瓷片。碎瓷片的作用是 。
(3)B装置可用于CO还原CuO的实验。该实验现象是 。
某复合肥的部分说明书如图所示。请回答:
(1)从肥效的角度看,共有种有效元素 。
(2)该复合肥的有效成分之一是尿素[CO(NH2)2],则尿素中碳、氧、氮、氢的原子个数比为 。
(3)一袋该化肥至少含P2O5 kg。
(4)从“注意事项”看,该复合肥料的物理性质是 ,化学性质是 (写一种)。

根据图1回答有关问题.

(1)仪器E的名称为 .
(2)图A~C是常见实验基本操作.其中正确的是 (填序号);请选择一个有错误的操作写出改正方法: .
(3)选择仪器D~I完成下列实验操作:
①用KMnO4制备O2,应选仪器 (填序号),其化学反应方程式为 ;
②用大理石与稀盐酸反应制备CO2并使反应随时发生或停止,应选仪器 ,
其反应方程式为 .
(4)图2是以锌粒和稀硫酸反应制备H2,并用排水法收集.请把图补画完整.

小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜Cu(OH)2═CuO+X,于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为 。
(2)制取氢氧化铜的化学方程式为 。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
[查阅资料]Cu和Cu2O均为红色固体,且Cu2O+H2SO4═Cu+CuSO4+H2O。
[提出猜想]红色固体是:Ⅰ.CuⅡ.Cu2OⅢ. 。
[进行实验]
操作 |
现象 |
结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 |
溶液由无色变蓝色,固体减少。 |
1.44g红色固体一定有: |
②过滤、洗涤、干燥。 |
得红色固体 |
[结论分析]
①据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想 也有相同现象。
②氧化铜高温灼烧由黑色变成红色的化学方程式为: 。
③如要确定1.44g红色固体成分,还需要补充的操作是 ,再通过 得出结论。
甲班学生做完实验室制备氧气和还原金属氧化物的实验后,剩余物质倒入同一废液缸里。乙班课外兴趣小组同学进行了如图所示的探究。(二氧化锰在常温下不和酸反应)请回答:

(1)步骤①的操作名称是 ,所用到的玻璃仪器有漏斗、玻璃棒和 。
(2)由步骤②实验现象推知,甲班同学制取氧气所用的固体反应物是 (写化学式)。
(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,该反应的化学方程式为 。
(4)由步骤③产生的气体判断固体A中一定含有 (写名称);综合步骤③④现象推理,固体A中还可能含有的物质是 (写至少两种物质的化学式)。
(5)根据上述实验和分析判断固体C是 (写化学式)。
试题篮
()