“少一些烟尘,多一片蓝天,建设文明城市,人人有责”
(1)汽车尾气在装有催化剂的净化器中反应的微观过程可用下图表示:

①该反应中没有发生改变的粒子是 ;(填“分子”“原子”或离子”)
②写出上述反应的化学方程式: 。
(2)煤燃烧时产生的二氧化硫是形成酸雨的主要气体之一,可用 来测定雨水的酸碱度,请你提出一条防止酸雨发生的建议: 。
2017年6月11日,兰州国际马拉松赛如期举行。兴奋剂是国际体育界违禁药物的总称,甲基苯丙胺(C 10H 15N)是兴奋剂的一种,称之为"冰毒",该药小剂量时有短暂的兴奋抗疲劳作用。
(1)甲基苯丙胺中碳、氢、氮的质量比为 。
(2)14.9g甲基苯丙胺中氮元素的质量为 。
某校初三化学课在进行氢氧化钠化学性质教学时,同学们做了如下实验:将一定量的稀盐酸加入到盛有NaOH溶液的小烧杯中。
(1)请写出该反应的化学方程式: 。
【提出问题】实验过程中未观察到明显现象,对此同学们产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对以上疑问,第一小组同学提出如下猜想:
猜想一:只有NaCl 猜想二:有NaCl和HCl
猜想三:有NaCl和NaOH 猜想四:有NaCl、HCl和NaOH
(2)肖晓同学对以上猜想中有一种是不可能的。不可能的猜想是
【实验探究】为了验证其余猜想,各小组同学利用烧杯中的溶液,进行下列实验:
| 实验方案 |
实验操作 |
实验现象 |
实验结论 |
| 方案一 测烧杯中溶液的pH |
① |
试纸变色,与标准比色卡对比,pH<7 |
溶液中有HCl |
| 方案二 滴加CuSO 4溶液 |
取少量烧杯中的溶液于试管中,滴加几滴CuSO 4溶液 |
无明显现象 |
溶液中一定没有:② |
| 方案三 滴加Na 2CO 3溶液 |
取少量烧杯中的溶液于另一支试管中,滴加少量Na 2CO 3溶液 |
③ |
溶液中有HCl |
| 方案四 滴加AgNO 3溶液 |
再取少量烧杯中的溶液于另一支试管中,滴加少量AgNO 3溶液 |
产生白色沉淀 |
溶液中有HCl |
【得出结论】通过实验探究,全班同学一致确定猜想三是正确的。
【评价反思】老师对同学们能用多种方法进行实验探究,并且得出正确结论给予表扬,同时指出以上实验结论中有一个是错误的,请你指出错误的结论并说明原因: 。
早在春秋战国时期,我国就开始生成和使用铁器了。工业上炼铁的原理利用一氧化碳和氧化铁的反应。某校化学兴趣小组利用如图装置进行炼铁原理的实验探究(夹持装置省略)。请按要求填空:

(1)写出装置A中反应的化学方程式: 。
(2)装置B的作用为 ,写出其中反应的化学方程式: ;
(3)当装置D硬质玻璃管中看到的现象为 、装置E中看到的现象为 时,说明装置D中反应发生了。
(4)同学们在讨论实验时,发现该装置存在一个不环保的缺陷,请你指出来: 。
实验室利用如图所示装置进行实验,请回答下列问题。
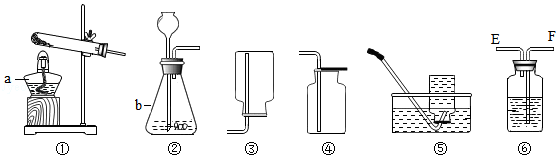
(1)写出图中标有字母的仪器名称:a: ;b: 。
(2)王鸿同学欲用高锰酸钾制取氧气,他选用的发生装置是 (填序号),实验时在该装置试管内靠近管口位置放一团棉花,其目的是 ;请你帮他写出反应的化学方程式: 。
(3)同学们欲用大理石和稀盐酸制取并获得干燥纯净的二氧化碳,选用装置②、④外,还选用了装置⑥两次,装置⑥中的液体依次是饱和碳酸氢钠溶液和浓硫酸,其作用分别是 、 ,气体应从装置⑥的(填"E"或"F") 端进入。
日常生活中使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所填充,其结构如图1所示。某学校化学兴趣小组的同学准备从废旧的干电池中分离出二氧化锰,并制备硫酸锌固体。
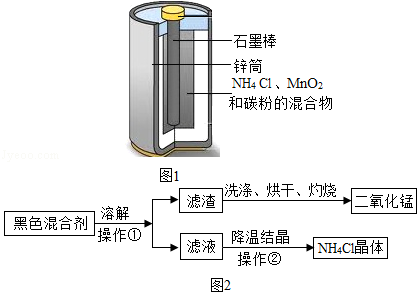
Ⅰ:设计回收二氧化锰的流程如图2所示:
(1)操作①和操作②的名称都是 ,该操作中玻璃棒的作用是 。
(2)上述操作中灼烧滤渣的目的是 。
(3)为了有效回收、利用二氧化锰,小茗同学用回收的二氧化锰与双氧水来制取氧气,请你写出该反应的化学方程式 。
Ⅱ:制备硫酸锌固体的实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应
②将滤液加热浓缩,得到热的饱和溶液
③将上述反应后的混合物过滤
④降温结晶
⑤过滤,得到ZnSO 4•7H 2O晶体
(1)正确的实验操作顺序为(填序号) 。
(2)步骤①中反应的化学方程式 。
Ⅲ:废旧干电池随意丢弃会造成环境污染。请你指出对废旧干电池的处理意见(只填一条): 。
如图框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B、D属于金属氧化物,M是一种常见的酸,N是一种黑色固体,G是金属单质,它们之间的相互转化关系如图所示(部分生成物已略去)。请回答:

(1)写出下列物质的化学式:C ,M 。
(2)写出②的反应类型: 。
(3)写出③的化学方程式: 。
(4)写出一条生活中G的常见用途 。
盐酸可以除铁锈。
(1)将一根生锈的铁钉放入足量的稀盐酸中,观察到铁锈逐渐消失,溶液由无色变成 ,该反应的化学方程式为 ,其基本反应类型为 。一段时间后,又观察到铁钉表面有气泡产生,该反应的化学方程式为 。
(2)写出一种防止铁制品锈蚀的方法 。
实验室常用下列装置来制取气体:

回答下列问题。
(1)写出仪器的名称:a ,b 。
(2)用B、E装置可以制取氧气,写出该反应的化学方程式 。用E装置收集氧气的依据是 ,检验氧气是否集满的方法是 。
(3)用B、D装置可以制取另一种气体,写出该反应的化学方程式 。
(4)用F装置代替C装置收集气体时,先将F装置装满水,再将气体从 (填“①”或“②”)通入。
根据化学方程式进行计算。二氧化碳通入足量的石灰水生成沉淀10g,与石灰水中的氢氧化钙反应的二氧化碳是多少g?
某研究小组对过氧化氢溶液制取氧气进行如下探究
实验一氧气制取和性质实验
(1)现有如图1装置

①实验室用过氧化氢溶液制氧气的化学方程式为 ,应选择的发生装置和收集装置分别是 (填标号,下同)和 。
②检查B装置气密性的操作是 。
③用收集的氧气进行“铁丝在氧气中燃烧”的实验,观察到的现象是 ,反应的化学方程式为 。
实验二 探究H2O2质量分数、溶液pH、温度对反应速率的影响
(2)设计如下表实验方案:
实验序号 |
H2O2质量分数/% |
pH |
温度/℃ |
每分钟气泡数 |
1 |
30 |
5 |
20 |
|
2 |
30 |
6 |
20 |
|
3 |
30 |
11 |
20 |
|
4 |
15 |
11 |
30 |
|
5 |
a |
11 |
b |
①实验1~3的实验目的是 。
②a= ;b= 。
实验三 探究制取氧气的适宜催化剂
(3)实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取30粒含MnO2的海藻酸钠微球,采用图2装置进行实验。改用其他三种微球,分别重复上述实验,得到图3的锥形瓶内压强随时间变化的曲线图。

①每次实验时,海藻酸钠微球数应相同的原因 。
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是 。
③从实验曲线看,催化效果较好、反应温和的催化剂是 。
漳州小吃手抓面,制作时要用发到大树碱,大树碱的主要成分是K 2CO 3.为了测定大树碱中K 2CO 3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是 .
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是 .
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是 .
(4)向配好的溶液中逐渐加入CaCl 2溶液,生成1g沉淀(假设大树碱中其它成分不参与反应,反应的化学方程式为CaCl 2+K 2CO 3═CaCO 3↓+2KCl).计算大树碱中K 2CO 3的质量分数?(要写出计算过程)
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K 2CO 3的质量分数 (填"偏大"或"偏小")

(1)写出图1A中一种玻璃仪器的名称 。
(2)用高锰酸钾制取氧气时,选用的发生装置是 (填序号,下同),收集装置是 ;装药品时还需要的实验用品是 ,反应的化学方程式是 。
(3)如图2是a、b、c三部分组成的实验装置图。a处反应的化学方程式是 ;b处的现象是 ;一段时间后,c处0以上的棉花团比0以下的棉花团变红色的个数 (填“多”或“少”),原因是 。

如图是某反应的微观粒子示意图。
(1)根据化学反应的本质,反应物的方框内还应补充的粒子及数目是 。
A.一个  B.两个
B.两个  C.一个
C.一个  D.两个
D.两个 
(2)两种生成物分子的共同之处是 ,该反应属于基本反应类型中的 反应。

试题篮
()