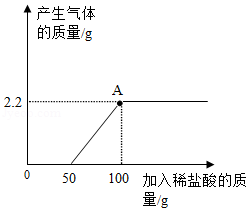
向部分变质的NaOH溶液中逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:
(1)完全反应后,产生气体的质量是 g。
(2)当滴加稀盐酸至图中A点时,溶液中含有的溶质是 。
(3)计算所加稀盐酸中溶质的质量分数。(写出规范的计算过程)。
电解法是工业上制铜的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO 4+2H 2O  2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
回答下列问题:
(1)原硫酸铜溶液中溶质的质量分数是多少?(写出解题过程)
(2)向电解后得到的488.0g溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同。则这种物质可能是下列物质中的 (填选项编号)
A.Cu B.CuO C.Cu(OH) 2D.CuCO 3
某化肥厂生产的一种化肥包装袋上的说明如图所示,化学兴趣小组为测定其纯度,取样品5.6克,完全溶于水,向所得溶液中加入100克一定溶质质量分数的硝酸银溶液,恰好完全反应生成14.35克沉淀(杂质不与硝酸银溶液反应)。通过计算回答。
(1)所用硝酸银溶液的溶质质量分数;
(2)该化肥是否合格(结果精确到0.1%)。

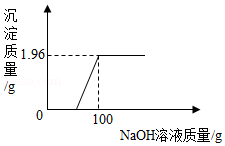
向一定质量的酸性CuSO 4溶液(含少量H 2SO 4)中逐滴加入NaOH溶液,产生沉淀的质量与所加入NaOH溶液的质量关系如图所示。
(1)当加入NaOH溶液的质量为30g时,溶液中的溶质是 (化学式)。
(2)计算所加NaOH溶液的溶质质量分数。

酸奶作为世界公认的长寿食品之一正愈来愈受到人们的重视和喜爱。酸奶中的酸味来自乳酸(化学式为C3H6O3)。
(1)酸奶主要提供人类营养物质中的哪一类? 。乳酸在人体内可被完全氧化为CO2和H2O,1.8 g乳酸完全氧化消耗O2的质量为 g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100 mL酸奶和100 mL蒸馏水于烧杯中,慢慢滴入0.4%的 NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示。计算该酸奶中乳酸的含量为多少克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0 g/mL,计算结果精确到0.01,无计算过程不给分)。

某化工厂排放的废水中含有H2SO4和CuSO4两种污染物。为测定废水中两种污染物的含量,给该化工厂提供污水处理的参考,某化学小组进行了以下实验:取该废水100g,向其中加入溶质质量分数为10%的NaOH溶液,测得生成沉淀的质量与加入NaOH溶液的质量关系如图所示,回答下列问题(写出计算过程):
(1)100g废水中含CuSO4的质量为多少?
(2)废水中H2SO4的质量分数为多少?
水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下(气体产物已略去):

回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的 反应;反应Ⅱ除产生水垢外,还有一种气体产物为 ;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是 。
(2)向200g水垢中加入400g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如下表所示:
时间/s(秒) |
0 |
30 |
60 |
90 |
120 |
180 |
混合物的质量/g |
600 |
574 |
554 |
547.2 |
547.2 |
547.2 |
①观察到的现象是 。
②计算水垢中碳酸钙的质量分数,写出必要的计算过程。
某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸(该产品中其它物质不与氢氧化钠反应),消耗氢氧化钠溶液的质量与反应过程中溶液的pH值关系如图所示。
(1)图中A点表示的意义是 。
(2)求这一石油产品中残余硫酸的质量(写出计算过程)。

生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
烧杯质量 |
样品的质量 |
稀盐酸的质量 |
烧杯+剩余物的总质量 |
50g |
5.8g |
94.6g |
150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为 g;
(2)样品中碳的质量分数 (计算结果保留到0.1%);
(3)反应后得到的溶液中溶质的质量分数(计算结果保留到0.1%)。
某实验小组同学做中和反应实验时,向80g质量分数为10%的氢氧化钠溶液中逐滴加入稀硫酸,当恰好完全反应时,共用去稀硫酸62g。请你计算:
(1)氢氧化钠溶液中溶质的质量为 g。
(2)反应后所得溶液中溶质的质量分数?
中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4•7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
(1)请写出铁与稀硫酸反应的方程式 。
(2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4•7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
[查阅资料]
①FeSO4易被空气中的氧气氧化成Fe2(SO4)3而变质。
②Fe2+在溶液中呈浅绿色,Fe3+在溶液中呈黄色。
③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
[猜想与假设]猜想1:该硫酸亚铁溶液没有变质。
猜想Ⅱ:该硫酸亚铁溶液已经变质。
[设计实验并验证]
实验操作步骤 |
实验现象 |
实验结论 |
取少量样品于试管中,加入2﹣3滴 溶液 |
试管中溶液变成血红色 |
|
[实验拓展1]下列各组物质在溶液中能大量共存,且形成无色溶液的是 。
A.CuSO4、NH4Cl、Ba(OH)2
B.FeSO4、Na2SO4、KCl
C.FeCl3、NaOH、HCl
D.NaCl、MgSO4、KNO3
[实验拓展2]该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量铁粉,写出其中的化学方程式 。
我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了突出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠,现有该样品混合物20.4g,将其放入一洁净的烧杯中,向其中逐滴滴入7.3%的稀盐酸,放出气体质量与滴加稀盐酸质量的关系如图所示。请回答下列问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填"<"">"或"=");
(2)该样品混合物中碳酸钠的质量 g;
(3)当滴加稀盐酸至图中A点时,烧杯中所得溶液为不饱和溶液,请计算此时溶液中的溶质质量分数。(写出计算过程,计算结果保留至0.1%)。

某学习小组对碳酸钠、碳酸氢钠和稀盐酸的反应进行了探究。
(1)分别在盛有少量碳酸钠(俗称 )、碳酸氢钠固体的试管中加入足量稀盐酸,观察到都剧烈反应且产生大量气泡。碳酸氢钠和稀盐酸反应的化学方程式为 。
[提出问题]
碳酸钠、碳酸氢钠和稀盐酸反应产生二氧化碳的快慢是否相同?
[设计与实验]
(2)甲设计的实验如图1所示,实验时,两注射器中的稀盐酸应 (填操作),观察到图2所示现象。于是他得出碳酸氢钠和稀盐酸反应产生二氧化碳较快的结论。

(3)乙对甲的实验提出了质疑:
①碳酸钠、碳酸氢钠固体和稀盐酸反应都很剧烈,通过观察很难判断产生气体的快慢;
② ,他认为,应取含碳元素质量相同的碳酸钠和碳酸氢钠,若碳酸钠的质量仍为0.318g,应称取 g碳酸氢钠。
(1)小组同学在老师指导下设计了图3所示的实验。

①连通管的作用是 。
②分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液(各滴2滴酚酞溶液),以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,溶液颜色变化记录如表1.广口瓶内压强随时间变化如图4所示。
表1:
滴入酚酞溶液 |
滴入稀盐酸,溶液颜色变化 |
|
碳酸钠溶液 |
红色 |
红色→浅红色→无色 |
碳酸氢钠溶液 |
浅红色 |
淺红色→无色 |
[实验结论]
(5)分析图4所示的实验数据可得到的结论是:相同条件下, 和稀盐酸反应产生二氧化碳较快,理由是 。
[反思与应用](6)小组同学分析表1实验现象和图:4数据,得出另一种物质和稀盐酸反应产生二氧化碳较慢的原因是 (请用必要的文字和化学方程式说明)。
(7)通过以上探究与分析,小组同学设计了只用试管和胶头滴管鉴別碳酸钠溶液和稀盐酸的实验。
操作 |
现象与结论 |
未知溶液分別编号为a、b,取适量a于试管中,用胶头滴管逐滴滴入b并振荡 |
|
试题篮
()