从26﹣A、26﹣B两题中任选一个作答,若两题均作答,按26﹣A计分。
26﹣A |
26﹣B |
的乙醇( )溶液常用作消毒剂。 (1) 属于_______(填“有机化合物”或“无机化合物”)。 (2) 中氢原子与氧原子的个数比为 _______。 |
的过氧化氢溶液可用于伤口消毒。 (1) 属于 _______ (填“纯净物”或“混合物”)。 (2) 中氢元素与氧元素的质量比为_______。 |
水是一种重要的资源,它与人类的生产、生活密切相关。
(1)生活中既可以降低水的硬度,又可以杀菌的方法是_____。
(2)生产、生活中防止水污染的措施有_______________(写一点)。
(3)甲、乙、丙三种固体物质在水中的溶解度曲线如图所示。回答下列问题:

① 时,甲的溶解度是_____。
② 时,等质量的甲、乙、丙三种物质的饱和溶液中,溶剂质量最小的是_____(填“甲”、“乙”或“丙”)。
③乙中混有少量的甲,可用_____的方法提纯乙。
④将丙溶液由 点转化到 点的方法是_____。
端午节是中华民族的传统节日,这一天小美妈妈准备了丰盛的晚餐。
(1)小美一进家门,就闻到粽子的香味,从微观的角度解释闻到香味的原因是__________。包粽子的原料之一是糯米,糯米中富含的营养素是_____。
(2)妈妈煮菜时用了加碘食盐。人体缺碘可引起_____。
(3)饭前,小美用酒精消毒液洗手。酒精能杀菌消毒的原因是__________。
(4)饭后,小美从报纸获悉“2021年9月,中国科学家在《科学》杂志撰文宣告首次实现了由
到淀粉
的人工全合成。”合成淀粉的总反应化学方程式为:
 ,则
的值为_____。该技术除有望缓解粮食危机外,还可缓解环境问题中的_____效应。
,则
的值为_____。该技术除有望缓解粮食危机外,还可缓解环境问题中的_____效应。
请用数字和化学符号填空:
(1)氦元素 _____;
(2)小苏打 _____;
(3)三个硫离子 _____;
(4)常温下呈液态的金属 _____。
阅读下列材料,结合所学的化学知识回答问题:
2021年11月,第26届联合国气候大会在英国格拉斯哥召开,讨论的核心物质仍是 ,如何降低大气中 浓度,是人类一直在研究的重要议题。全球碳循环如图所示:

对二氧化碳的综合利用是国际研究的热点,如:工业上可以将 转化成尿素、甲醇等资源;科学家还发现了一种镍与有机物组成的混合催化剂,利用太阳光能,可将水中溶解的 转化成 和 ;我国科学家在实验室首次实现了利用 直接人工合成淀粉 ,这是中国科学家在人工合成淀粉方面取得的颠覆性、原创性突破。
(1)在全球碳循环中,大气中二氧化碳的来源有 __________(写一条),降低大气中二氧化碳含量的途径有__________(写一条)。
(2)工业上将二氧化碳转化为甲醇的化学方程式为:
 ,其中
的化学式为_____。
,其中
的化学式为_____。
(3) 在一定条件下生成 和 ,该反应的基本反应类型是_____。
(4)“我国科学家利用二氧化碳直接人工合成淀粉”的意义:__________(写一条)。
第24届冬奥会在我国如期举行,“绿色、科技、文化”是本届冬奥会的特点。

(1)北京烤鸭是中国特色美食。从营养角度考虑,烤鸭能给人们提供的最主要的营养素是_____(选填“糖类”、“蛋白质”或“维生素”)。
(2)北京冬奥会颁奖礼服的内胆添加了石墨烯(单层石墨)发热材料,其原理是将电能转化为热能且均匀传递,据此可知石墨烯具有的性质有_____(写一条)。
(3)北京冬奥会主火炬与赛场内的公交车首次用氢气作燃料,选择氢气替代天然气作燃料的优点_______________。
(4)碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。
碲在元素周期表中的信息及原子结构示意图如图所示:请判断碲原子核内的质子数是 _____,你还能获得的信息是__________(写一条)。

2021年12月9日和2022年3月23日,宇航员进行了两次太空授课,解答同学们的疑问,传播和普及科学知识,凸显了我国蓬勃发展的航天事业!
(1)宇航员所用的“再生水”是收集的尿液和舱内冷凝水经净化系统处理后形成的蒸馏水。在日常生活中净化水时常利用活性炭的_____性除去色素和异味。
(2)宇航员需要的氧气是通过电解水得到的,其反应的化学方程式为____________________。
(3)王亚平老师将一片泡腾片放入蓝色水球中,球内迅速产生气泡,并闻到了阵阵香气。从分子的角度分析“闻到香气”的原因是__________。
(4)“冰雪实验”是运用结晶的原理。乙酸钠在不同温度时的溶解度如表所示:
温度( ) |
|
|
|
|
|
|
|
|
溶解度( ) |
|
|
|
|
|
|
|
|
时,向盛有 水的烧杯中加入_____ 乙酸钠固体,搅拌,恰好形成饱和溶液,将其饱和溶液降温到 时,可观察到的现象是__________。
碳酸钡( )是制造高级光学玻璃的重要原料,工业上以重晶石(主要成分为 )为原料生产碳酸钡的流程如图:

已知:焙烧温度为 : 易溶于水。
回答下列问题:
(1) 又名“钡白”,据此推测 具有的物理性质是_____。 的化学名称是_____。
(2)“焙烧”时生成 ,该反应的化学方程式是__________,该反应中化合价降低的元素是_____(填元素名称)。
(3)“沉钡”时,发生反应的化学方程式是_______________。
(4)检验“滤液2”中是否含有 的方法是 ___________________________________。
阅读下面科普短文。
氢能作为一种储量丰富、来源广泛、能量密度高的清洁能源,已引起人们的广泛关注。氢的规模储运是现阶段氢能应用的瓶颈。根据氢气的特性,其储存方式可分为物理法和化学法两大类。物理法主要有低温液化储氢、高压压缩储氢、碳基材料储氢等。化学法主要有金属氢化物储氢、配位氢化物储氢等。
低温液化储氢是一种极为理想的储存方式,但面临两大技术难题:一是氢液化能耗大,二是对储氢罐的绝热性能要求极高。高压压缩储氢的最大优点是操作方便、能耗小,但同时也存在不安全和对储氢罐强度要求较高的缺点。金属氢化物储氢是把氢以氢化物的形式储存在金属或合金中,比液化储氢和高压储氢安全,并且有很高的储存容量,缺点是一般在最开始时并不具备吸氢的功能,需要在高温高压的氢气环境中进行多次的减压抽真空循环。如图为一些储氢材料(以储氢后的化学式表示)的质量储氢密度和体积储氢密度。

(已知:质量储氢密度=储氢后氢元素在储氢材料中的质量分数,体积储氢密度=储氢后单位体积的储氢材料中储存氢元素的质量)
目前,国家高度重视氢的安全、高效储存方式及材料的研究开发,以期在21世纪中叶进入“氢能经济”时代。
回答下列问题:
(1)“氢能”具有的优点是_____(填一点即可)。
(2)碳基储氢材料“碳纳米管”属于_____(填“单质”或“化合物”)。
(3)从分子的角度解释低温、高压储氢的原理:_______________。
(4)结合图示,下列储氢材料中最理想的是_____(填标号)。
| A. |
|
| B. |
|
| C. |
|
| D. |
|
(5) 储氢材料 中储存氢元素的质量是_____ 。储氢材料 的质量储氢密度是_____ 。
化学与生活、生产息息相关。回答下列问题:
(1)合成材料的应用和发展大大方便了人类的生活。下列常用物品的主要成分不属于合成材料的是_____(填标号)。
| A. | 羊毛大衣 |
| B. | 有机玻璃 |
| C. | 塑料薄膜 |
| D. | 汽车轮胎 |
(2)如图,用活性炭净水器净化自来水,净化后得到的水属于_____(填“纯净物”或“混合物”)。
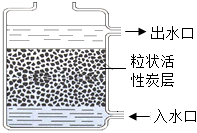
(3)炒菜时,锅内油温过高不慎失火,立即盖上锅盖,利用的灭火原理是_____。
(4)中科院科学家研发出新型催化剂,成功实现了二氧化碳直接加氢制取汽油。简要流程如图所示:
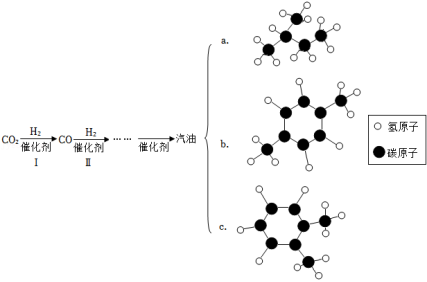
①制得的汽油中, 的化学式是_____; 的化学式相同,但性质有差异,导致这一现象的原因是_____。
②结合上述流程图,下列说法正确的是_____(填标号)。
| A. | 反应Ⅰ为化合反应 |
| B. | 反应过程中催化剂性质保持不变 |
| C. | 制得的汽油比氢气更加绿色环保 |
| D. | 大规模推广可有效缓解能源短缺问题 |
现有 六种元素。其中A元素原子的原子核中没有中子; 是地壳中含量最多的元素; 元素原子的核电荷数为 ; 元素组成的单质是目前世界上年产量最高的金属; 是“司母戊鼎”中的一种金属元素,其单质呈紫红色; 元素形成的单质在空气中燃烧、发出耀眼的白光。
(1)下列属于 元素的原子结构示意图是_____。

(2)写出由 两种元素形成的常见阴离子的符号_____。
(3) 元素的单质与 元素形成化合物的水溶液反应的化学方程式_______________。
(4)人体缺 元素可能会引起_____。
(5)为了判断 元素形成的三种单质的活动性强弱,设计了如下实验方案(方案中的单质经过打磨处理)、其中合理的是_____。
①把形状、大小相同的 元素形成的单质分别放入同浓度同体积的稀硫酸中
②把 元素形成的单质分别放入含 的低价盐溶液和E的盐溶液中
③把 元素形成的单质分别放入含 的盐溶液中
④把 元素形成的两种单质分别放入含 的低价盐溶液中
我国著名的化工专家侯德榜,为纯碱和氮肥工业的发展作出了杰出的贡献。侯氏制碱法的原理为:

(1) 属于_____(选填“酸”“碱”或“盐”),溶于水形成的溶液显_____性,其用途_______________(任写一条)。
(2) 中氮元素的化合价是_____价。
(3)写出碳酸钠溶液与澄清石灰水反应的化学方程式_______________。
(4) 是发酵粉的主要成分,它与厨房中食醋的主要成分反应如下:
,则X为_____(填化学式)。
(5)请设计实验方案鉴别 固体和 固体________________________________________。(写出操作、现象、结论)
铜矿冶炼铜时,得到一种黑色固体化合物 ,现设计以下流程对其进行探究。
已知: 为化合物,能使澄清石灰水变浑浊; 为单质。回答下列问题:
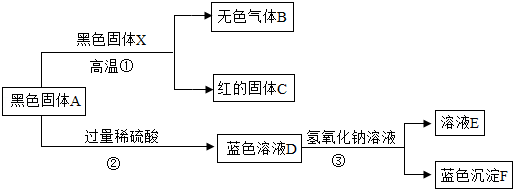
(1)反应①的化学方程式为__________,反应类型为_____。
(2)用一种无色气体 代替黑色固体 ,也能在加热条件下与A反应生成B和C,则 的化学式为_____。
(3)若③中逐滴加入 溶液,则蓝色溶液D中首先与 发生反应的物质的化学式为_____;反应③中生成蓝色沉淀 的化学方程式为____________________。
如表是 和 分别在不同温度时的溶解度。
温度/ |
|
|
|
|
|
|
|
|
溶解度/ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
根据数据,绘制二者的溶解度曲线如图所示, 点为曲线的交点。回答下列问题:
(1)下列说法错误的是_____(填标号)。
| A. | 二者的溶解度均随温度升高而增大 |
| B. | 曲线 为 的溶解度曲线 |
| C. | 点对应的温度在 与 之间 |
| D. | 点对应的溶解度在 与 之间 |
(2) 时,处于 点的 溶液_____(填“饱和”或“不饱和”)。欲将处于 点的 溶液转变为 点,可以采取__________(填“蒸发溶剂”“降低温度”或“增加溶质”)的措施。
(3) 时,饱和 溶液中混有少量的 ,应采用_____(填“蒸发溶剂”或“降温结晶”)、过滤的方法提纯 。
(4)若不改变溶剂的质量,将 时的 饱和 溶液降温至 ,能析出 晶体的质量为_____ 。

新型冠状病毒肺炎疫情防控期间,应合理使用消毒剂进行杀菌消毒。回答下列问题:
(1)用作消毒剂的医用酒精中乙醇的_____(填“质量分数”或“体积分数”)为 ,因其易燃,使用时应远离火源,乙醇燃烧的化学方程式为_______________。
(2)“ 消毒液”的有效成分是次氯酸钠,可由氯气与氢氧化钠溶液反应制得,反应的化学方程式为: (已配平),其中 代表次氯酸钠,则其化学式 _____。
(3)二氧化氯( )常温下为黄色气体,易溶于水,其水溶液是一种广谱消毒剂。 中氯元素的化合价是_____。
(4)过氧化氢溶液是一种绿色消毒剂,这种消毒剂的优点是____________________。
(5)过氧乙酸( )是一种高效消毒剂,它对热不稳定,易发生分解反应,生成乙酸( )和一种气态单质,这种气态单质为双原子分子,推测其化学式为 _____。
试题篮
()