下图是实验室常见的制取气体的装置: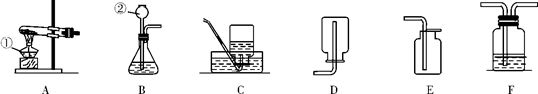
(1)写出上图中带标号仪器的名称:① ,② 。
(2)制取二氧化碳可以用B作发生装置,其收集装置通常是 (填字母),请写出实验室制二氧化碳的化学方程式 。
(3)实验室现在需要制取氧气,利用上面的仪器,还需要的药品是: (填名称)。
(4)我们做铁丝在氧气中燃烧的实验时,把红热的铁丝伸入装有氧气的集气瓶里,反应生成 (填化学式),做这个实验时盛氧气的集气瓶预先加少量水,水的作用是 。
【10新疆17】.某学习小组在探究“从空气中制取氮气”时,提出以下实验方案:
空气→除去二氧化碳和水蒸气→除去氧气→氮气
(1)除去二氧化碳和水蒸气:在甲装置的A中所装溶液是 。
(2)除去氧气:他们分别收集一瓶(1)中得到的气体,用图乙装置进行实验,小红选用红磷,小明选用木炭。他们俩中有一位同学选用的药品不合理,理由是 。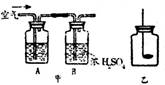
(3)分析误差:此法得到的氮气其密度与氮气的实际密度有误差,你认为产生误差的可能原因是(任写一种) 。
(10潍坊22).(8分)化学能转化为电能,在生产、生活中有重要的应用。
I.氢氧燃料电池是符合绿色化学理念的新型电池。
右图是氢氧燃料电池的示意图,电池工作时,H2和O2反应生成水,同时提供电能,溶液的pH (填“变大”“变小”“不变”)。
Ⅱ.某学校研究小组对废干电池筒内的黑色物质(可能含有C、MnO2、ZnCl2、NH4C1等)进行研究,实验过程如下: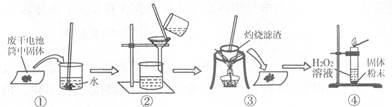
(1)操作②的名称是 ,操作③中玻璃棒的作用是 。
(2)操作④的试管中产生的气体能使带火星的木条复燃,产生该气体的化学方程式是 。
(3)ZnCl2和NH4Cl混合溶液中含有杂质CuCl2,会加速对电池的腐蚀,欲除去Cu2+,最好选用下列试剂中的 (填序号字母)。
a.NaOH b.Zn c.Fe d.Na2CO3
(10滨州24)、海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 ;
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。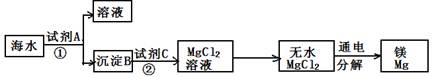
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ;由无水MgCl2制取Mg的化学方程式为 。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
氧化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过下操作流程: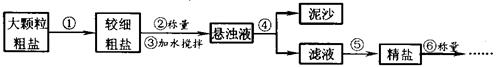
(1)操作①中必须用到的一种仪器是 ▲ (填序号)。
A.研钵 B.量筒
C.烧杯 D.试管
(2)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 ▲ (填序号)。
A. B. C. D.
(3)操作⑤中除用到三脚架、酒精灯、玻璃棒、坩埚钳外,还需要用到 ▲ 等仪器。该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连锁搅拌外还可采取 ▲ 等措施。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 ▲ (填序号)。
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上
酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)右图是某试剂瓶标签上的内容。要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g。稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因。
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验。全品中考网
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则无色溶液可能是 。
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据右图部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。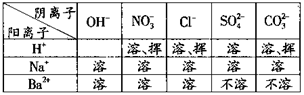
| 实验目的 |
实验操作 |
现象 |
结论或化学方程式 |
| 除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 溶液, 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 |
在滤液中滴加酚酞溶液 |
|
该样品中含有氢氧化钠 |
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。
大龙在公园看到绿化工人往树干上涂抹具有杀菌杀虫作用的悬浊液,对其成份产生了好奇,于是他带回了一些样本进行研究.
信息提示:许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫做焰色反应.如:钠﹣﹣黄色;钙﹣﹣砖红色;钾﹣﹣紫色;钡﹣﹣黄绿色
Ⅰ猜想与假设:该制剂可能为波尔多液
Ⅱ实验探究:
| 序号 |
实验步骤 |
实验现象 |
| ① |
取样,将其置于大试管中,加入一定量水,静置片刻 |
上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
| ② |
取少量中层液体滴加无色酚酞试液 |
无色酚酞试液变红 |
| ③ |
另取少量中层液体进行焰色反应 |
火焰呈现砖红色 |
| ④ |
取少量黄色固体灼烧 |
燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
| ⑤ |
向下层白色固体中滴加足量稀盐酸 |
固体完全溶解,但仅产生少量气泡 |
Ⅲ实验结论:
(1)根据上述实验①,可以判断该悬浊液中 (填“含”或“不含”)硫酸铜;
(2)根据上述实验 (填序号),可以判断该悬浊液中含有氢氧化钙;
(3)根据上述实验④,可以判断黄色固体是 ;
(4)写出⑤中发生的所有反应的化学方程式: .
过氧化氢俗称双氧水,可用过氧化钡(BaO2)与稀硫酸反应来制备。过氧化氢与过氧化钡都是过氧化物,过氧化物一般可用作氧化剂、漂白剂、供氧剂等。阅读下文并回答有关问题:
(1)实验室可用过氧化氢溶液制取氧气,其反应的化学方程式是___________________,
过氧化钡还可以通过以下方式制备过氧化氢:BaO2+X+H2O==BaCO3↓+H2O2,其中物质X的化学式是____________。全品中考网
(2)过氧化钠(Na2O2)也是一种过氧化物,潜水艇常用过氧化钠作供氧剂,同时维持艇内空气成分的稳定,写出这一反应的化学方程式________________________。
(3)由于过氧化钠具有强氧化性,常用它将某些难溶矿石转化为可溶性物质,例如三氧化二铬Cr2O3与Na2O2高温共熔得到铬酸钠Na2CrO4和氧化钠Na2O,铬酸钠中铬的化合价为_______,此反应的化学方程式是______________________________。
初中化学中的几种常见物质有下图所示的转化关系(部分反应物和生成物已略去),其中反应②常用于工业生产,反应③常用于实验室制备F气体。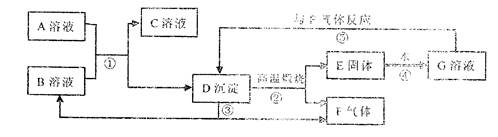
请回答下列问题:
(1)D的化学式是 ;A的化学式可能是 (任写一种)。
(2)反应⑤的化学方程式为 ;
(3)在四种基本反应类型中,上图未涉及的反应类型是 (填序号)。
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
请分别用一种试剂除去下列各物质中的杂质(假设所选试剂与杂质恰好完全反应)。
| |
物质 |
杂质 |
除杂质所用试剂(填化学式) |
| (1) |
CO |
CO2 |
|
| (2) |
NaCl |
Na2CO3 |
|
| (3) |
C |
CuO |
|
| (4) |
KCl |
Fe2(SO4)3 |
|
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。
I .海水提溴。从海水中提取的溴约占世界溴产量的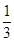 ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下: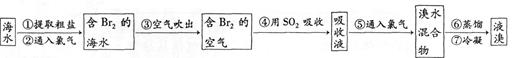
试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2 Br2+2KI=2KBr2+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是_______。
Ⅱ .食盐制碱。我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水。
四种盐在不同温度下的溶解度表: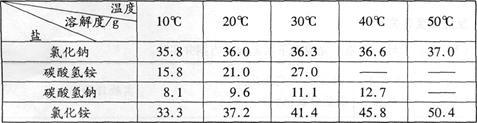
请回答:
(1)碳酸氢铵的化学式是 。
(2)由上表分析过程②中能发生反应的原因是 。
(3)过程③中反应的化学方程式是 。
医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水和氯化钙(CaCl2·2H2O)的流程如下图所示。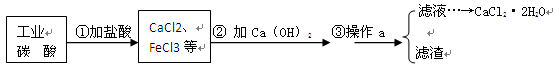
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
(2)第②步中是否发生化学变化? (填“是”或“否”)。
(3)操作a的名称是 ,实验室进行该操作时玻璃棒的作用是 。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一个合理的补钙方法: 。
(10福建省福州12.)小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图4(图中“——”表示相连的两种物质能发生反应)。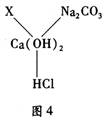
(1)若X是与其它三种不同类别的化合物,则X可以是__ __。
(2)根据图4所示的物质间关系,写出其中两个化学方程式:
① ;② 。
如图所示,某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,她从烧杯中取了少量反应后的溶液于一支试管中,并向试管中 滴加几滴无色酚酞试液.振荡.观察到酚酞试液不变色。于是 她得出“两种物质已恰好完全中和”的结论。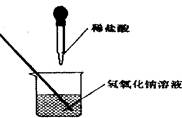
(1)你认为她得出的结论是 的(填“正确”或“错误”),理由是
(2)请你设计一个实验.探究上述烧杯中的溶液是否恰好完全中和。 请填写下表:
(10株洲26).(4分)如图是A、B两种物质的溶解度曲线,请回答: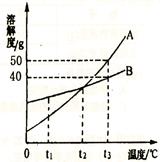
(1)t3℃时,把46g固体A放入100g水中,充分溶解后可得到A的 溶液(填“饱和”或“不饱和”)。
(2)t1℃时,A、B两种物质溶解度的大小关系为A B(填“>”、“<”或“=”,下同)。
(3)在其他条件不变的情况下,若把tl℃时A、B的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B:若把t3℃时A、B的饱和溶液分别降温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B。
试题篮
()