如右图所示,A、B、C是初中化学中常见液体、气体和固体,气球套在试管口且保证密封性能良好。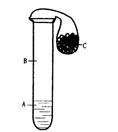
(1)若A能使紫色石蕊变红色,B为空气,将金属固体C倒人试管中产生气泡,同时气球因膨胀而鼓起来。则A是(填化学式) ,金属固体C是(填化学式) ,发生反应的化学方程式是 ;
(2)若B为空气,将黑色固体C倒人试管中产生气泡,同时气球因膨胀而鼓起来。则A是(填化学式) ,黑色固体C是(填化学式) ,发生反应的化学方程式是 ;
(3)若A是水,将气球中的固体C倒人试管中,气球很快被吸人试管中,则气体B是(填化学式) ,固体C是(填化学式) 。
右图A、B、C为三种物质的溶解度曲线,据图回答: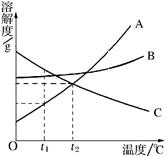
(1)t1℃时,A、B、C三种物质的溶解度由大到小顺序是 ;
(2)将t2℃时的等质量三种物质的饱和溶液分别降到0℃时,析出溶质最多的是 ,无溶质析出的是 ;
(3)当 A中含有少量B时,为了得到纯净的A,
可采用 的方法;
(4)若将t2℃三种物质的饱和溶液分别降到t1℃时,则三种溶液中溶质的质量分数由大到小的顺序是
选择“低碳生活”,减少二氧化碳排放,是每位公民应尽的责任和义务。
①生活中少用10个塑料袋可以减少约0.02molCO2排放。CO2的摩尔质量是 (6) ;它属于 (7) 氧化物(填“酸性”或“碱性”)。 0.02molCO2约含有 (8) 个CO2分子。
②“低碳交通”鼓励使用新能源,氢能是最清洁的能源,写出氢气燃烧的化学方程式
(9) 。
③回收可利用的资源,如旧手机中的金属。手机机芯中含有铜、金、银等。写出银的化学式 (10) 。下图是实验室制取金属铜的流程图: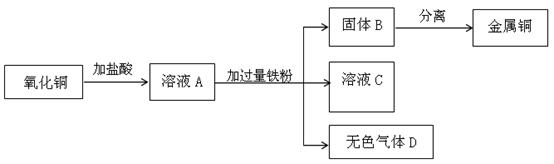
Ⅰ.氧化铜与盐酸反应的化学方程式是 (11) 。
Ⅱ.溶液A的溶质组成是 (12) 。
Ⅲ.在固体B中加入过量的 (13) 溶液,再通过 (14) 的分离方法得到金属铜。
欲除去下列物质中混有的少量杂质,请选择所用试剂并写出反应方程式:
| 混合物 |
所用试剂 |
化学方程式 |
| (1)铜粉中混有铁粉 |
|
|
| (2)氯化钠溶液中混有碳酸钠 |
|
|
| (3)硫酸钠中混有硫酸铵 |
|
|
| (4)硝酸钠中混有氯化钠 |
|
|
实验室有以下三组实验装置,根据装置回答下列问题: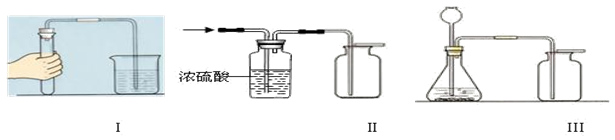
(1)图Ⅰ的实验操作目的是 ,从该图观察到的实验现象中,你能得出的结论是 。
(2)能用图Ⅱ所示装置干燥并收集的气体应具有的性质是 。
(3)某同学用装置Ⅲ制取了一瓶无色无味的气体(纯净物),你推断该气体可能为 。(填化学式),请使用最简单的方法验证你的推断: 。
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。
(1)碳元素的化学性质与其原子的 关系密切。
(2)下图为元素周期表中的一格,下列说法不正确的是 (填标号)。
| A.碳元素属于非金属元素 |
| B.碳原子核内质子数为6 |
C.碳元素的原子结构示意图为 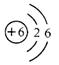 |
| D.碳的相对原子质量为12.01g |
(3)写出下图装置中所发生反应的化学方程式为 ;实验室确定气体发生装置时应考虑的因素是 ;检查该装置的气密性的方法是:将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到 现象,即可证明装置不漏气。
(4)甲、乙、丙都是常见含有碳元素的物质,它们之间有如右图所示的转化关系(部分物质和反应条件已略去)。其中甲和丙都可以作燃料,乙和丙中所含的元素种类相同。乙能引起“温室效应”,则乙的化学式为 ;甲转化为乙的途径有多种,写出通过置换反应的方式甲转化为乙的化学方程式为 。从微观的角度解释乙、丙性质有差异的原因是 。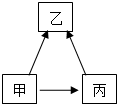
(5)工业上用一氧化碳还原氧化铁炼铁。现用50t含80%氧化铁的赤铁矿石最多能冶炼出
多少吨铁?
在下面关系图中,A、B、C、D是初中化学中常见的单质,甲、乙分别是酒精完全燃烧时生成的两种物质,丁是常用建筑材料的主要成分,G为无色有刺激性气味的气体,能使紫色石蕊试液变蓝,J是赤铁矿的主要成分。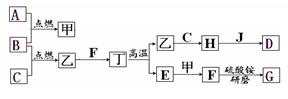
(1)写出化学式:甲是 ,G是 ;
(2)写出物质乙与物质C化合成H的化学方程式: ,该反应是 (填“放热”或“吸热”)反应。
(3)足量的J溶解于稀盐酸中,溶液呈黄色,写出该反应的化学方程式: 。
下图是A、B两种固体物质的溶解度曲线图,请回答下列问题: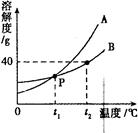
(1)P点表示t1℃时,A的溶解度____B的溶解度(填“>”、“<”或“一”)。
(2)在其他条件不变的情况下,若把t1℃时A、B的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数关系为A____B(填“>”、“<”或“=”)。
(3)t2℃时,将30g B物质加入50g水中,所得溶液是____(填“饱和”或“不饱和”)溶液,所得溶液的质量为______g。
4分)已知A、B、C、D、E、F为六种常见化合物,它们的相互反应及转化关系如图,B为参与植物光合作用的气体,E通常为无色液体,请回答:
(1)B的化学式为 ;(2)D的俗称是 ;
(3)D → F的反应属于基本类型为: 。
(4)B与C反应生成E和F的化学方程式: 。
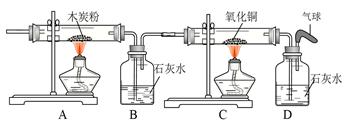
下图是实验室常用的装置,请回答下列问题:
⑴写出仪器①的名称 。收集某气体能采用E装置,由此推测该气体具有的
性质是 。
⑵实验室制备并收集氧气的装置组合是 (填装置序号),反应的化学方程式为 ;若用F装置收集该气体,则气体应从 端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是 。
⑶实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项字母编号)。
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
(4)将氧气通入如下图所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固
体变为红色,则进入装置B的气体一定含有 ,B处发生反应的化学方程式是 。
⑸实验室制取氧气时常用二氧化锰作催化剂。某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
①如下图所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是 。
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入
装置进行证明。
③现称取5.0 g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)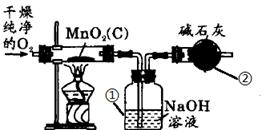
归纳总结对比分析是学习化学常用的科学方法,如图所示:两圆重叠的区域表示它们的共同特征(相似点),重叠区域以外的部分表示它们的独有特征(不同点)。
(1)观察A图,从组成角度写出与上图区域①相对应的适当内容 。(填一点)
(2)观察B图,写出符合②的酸的化学性质 、 。(填两点)
还可看出酸和碱都能与某些盐发生反应,请你写出既能与盐酸反应,又能与熟石灰发生化学反应一种盐的化学式为 。
(3)观察C图,从物质分类上写出符合④⑤的物质的化学式 ; 。
已知:A、B、C、D、E、F六种物质是初中化学常见的物质。A、B是单质,C、D、E都是氧化物。A、B、C转化为F的过程较为复杂,F的成份也较复杂,其主要成分是一种红色的固体。D和F的主要成分所含元素相同,E和C中所含元素相同,试根据各物质间的转化关系完成下列各题。(题中给出的是主要产物,反应条件未给出。)
(1)写出F中主要成分的化学式: 。
(2)写出下列物质转化的化学方程式:F+G→A: ;C→B: ;
(6分)A是常见金属单质,B、C是非金属单质,且C是密度最小的气体,甲是磁铁矿的主要成分,它们之间有如下的转化关系(部分产物和反应条件未标明)。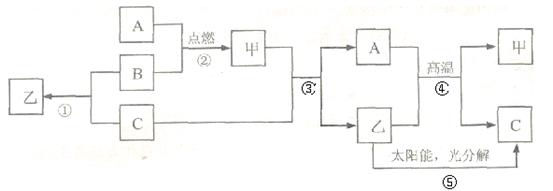
(1)推断甲、乙的化学式为:甲 ,乙 ;
(2)写出反应③的化学方程式 ,该反应体现出物质C的
性,在①②③④⑤五个反应中,属于置换反应的有 个;
(3)反应①除了具有放出热量多,原料不受限制的优点外,还有 的优点。
下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答: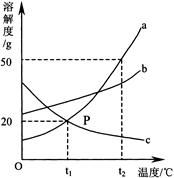
(1)P点的含义是 。
(2)t2℃时30g a物质加入到50g水中不断搅拌,形成的是 (填“饱和”或“不饱和”)溶液,所得溶液质量为 g。
(3)a中混有少量的b,若要从混合液中分离出a可采用的方法是 。
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是 。
6分)下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
用上图表示的序号表示配制溶液的正确顺序_____ ____。
图②中,有一种塑料仪器,其名称是___ ______。
称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见右图,则称取的NaCl质量为 。
根据计算需要量取水的体积是 (水的密度为1g/mL)。量取读数时,右图视线角度正确的是_______。(选填字母标号)
称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”、“小于”或“等于”)10%。
试题篮
()