已知A、B、C、D是初中化学常见的四种不同类别的化合物,A为人体胃液中的酸,农业上B常用于改良酸性土壤,B与C反应常用于工业上制烧碱,D含量过多会导致温室效应加剧。它们相互反应及转化关系如图。("﹣"表示相互之间能发生反应,"→"物质之间存在转化关系,部分反应物和生成物略去)请回答下列问题:
(1)A物质的一种用途
(2)D的化学式 ;B的俗名是
(3)B与C反应的化学方程式是 ,该反应的基本反应类型 。
(4)B与D反应的化学方程式是 ;
(5)我们中学生是传播"低碳"理念,倡导"低碳"生活的先行者,请你提出一条"低碳"生活的具体做法: 。

某化学兴趣小组的同学学习"灭火器原理"后,设计了如图所示实验,并对反应后瓶中残留废液进行探究。

【提出问题】废液中所含溶质是什么?
【猜想与假设】
猜想1:废液中的溶质可能是NaCl、Na 2CO 3和HCl。
猜想2:废液中的溶质只有NaCl。
猜想3:废液中的溶质是NaCl和HCl。
猜想4:废液中的溶质是 。
【讨论与交流】
小明认为猜想1无需验证就知道是错误的,他的理由是 。(请用化学方程式说明)
【实验与结论】
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现酚酞溶液不变色,于是小亮认为猜想3正确。你认为他的结论 (填"正确"或"错误"),理由是 。
请你另设计实验方案验证猜想3:
| 实验步骤 |
实验现象 |
实验结论 |
|
|
|
猜想3正确 |
(2)验证猜想4,可选用的试剂有 。
A.酚酞溶液 B.氢氧化钾溶液 C.稀硫酸 D.氯化钡溶液。
【拓展与应用】
若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行 操作即可从废液中得到NaCl固体。
实验利用如图所示装置进行相关实验,请回答问题

(1)写出标有序号①仪器的名称 。
(2)实验室用高锰酸钾制取并收集氧气可选择的装置组合是 。写出该反应的化学方程式 。用此方法制取氧气的实验步骤有:①在试管中加入药品并固定好装置:②把导管移出水面;③点燃酒精灯加热,当气泡连续均匀冒出时开始收集;④熄灭酒精灯;⑤检查装置的气密性。下列排序正确的是 。
A.①⑤③②④
B.⑤①③②④
C.①⑤③④②
D.⑤①③④②
(3)实验室制取二氧化碳的药品是 。图F是某同学利用塑料瓶和其他用品设计的二氧化碳的发生装置,该设计与B装置比较除了废物利用的优点外,请另写出一个优点 。
某兴趣小组提供了一些气体制备和收集的实验装置,如图所示:按要求回答下列问题:
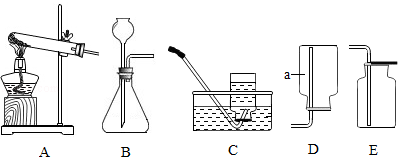
(1)a仪器的名称是 。
(2)若要用过氧化氢溶液和二氧化锰为原料制取氧气,应选用的发生装置为 (填字母编号),若要收集到干燥的氧气则收集装置为 (填字母编号)。
(3)用氯酸钾和二氧化锰为原料制取氧气,其中二氧化锰是催化剂,反应的化学方程式为 ,为了证明二氧化锰的催化作用,进行了如下实验。
①加热ag氯酸钾
②加热ag氯酸钾和bg二氧化锰混合物,充分反应后,将剩余固体进行溶解、 、洗涤…称量。
为了直观对比实验①、②产生氧气的快慢,应用装置 (填字母编号)收集氧气。
若①氯酸钾的分解速率比②明显减慢,且②中后称得固体质量为 g,则证明二氧化锰作催化剂。
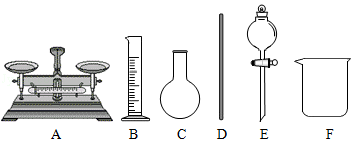
(1)"84消毒液"是现在家庭中常用的消毒剂和漂白剂(能使酸碱指示剂等有机色素褪色的物质),它的有效成分是NaClO."84消毒液"属于 (填"纯净物"或"混合物"),该消毒液呈碱性,我们 (填"能"或"不能")用pH试纸来测此溶液的pH,原因是 。(若"能"此空可不填)
(2)"84消毒液"制取原理为:Cl 2+2NaOH=NaClO+X+H 2O,则X的化学式为 。观察上述反应中物质及化合价变化的特点,硫与氢氧化钠溶液在加热条件下的反应与此类似,请填出空白处的物质的化学式:S+NaOH  Na 2SO 3+ +H 2O(未配平)
Na 2SO 3+ +H 2O(未配平)
(3)若配制"84消毒液"需要100g质量分数为a%的NaOH溶液,实验室配制该NaOH溶液,需要用到图中的玻璃仪器为 (填字母编号)。在配制过程量取水时,若仰视读数,会导致所配溶液溶质质量分数 (填"偏大"、"偏小"或"不变")。
某化学兴趣小组的同学在对稀盐酸、氢氧化钠、碳酸钠的化学性质进行探究的过程中遇到"异常"现象。
现象一:向试管中加入2mL某浓度的氢氧化钠溶液,再滴入2~3滴酚酞溶液,氢氧化钠溶液变红色;然后振荡试管,发现红色消失。
【提出问题】红色为什么会消失?
【猜想】(1)氢氧化钠溶液的量少了;(2)酚酞溶液的量少了;(3) 。
【查阅资料】酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式结构,当pH>8.2时为红色的锟式结构;在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐。
【实验探究】根据上述"猜想"进行如下探究
(1)取4mL同浓度氢氧化钠溶液,滴入2~3滴酚酞溶液,振荡后红色消失;
(2)取2mL同浓度氢氧化钠溶液,滴入4~5滴酚酞溶液,振荡后红色消失;
(3)取2mL同浓度氢氧化钠溶液,加适量水稀释,滴入2~3滴酚酞溶液,振荡后红色没有消失。
结论:猜想 正确。
【继续实验】取一定体积的稀氢氧化钠溶液,滴入2~3滴酚酞溶液,逐滴加入一定浓度的稀盐酸直至红色消失,写出反应的化学方程式 。微观角度分析,该反应的实质是 。
现象二:向碳酸钠粉末中逐滴加入稀盐酸,立即产生气泡;而向碳酸钠溶液中逐滴加入稀盐酸时,开始没有气泡,过一段时间后才有气泡产生。
【提出问题】碳酸钠溶液刚开始与稀盐酸是否发生了化学反应?
【实验探究】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的稀盐酸。
【收集证据】分别收集实验过程中不同阶段消耗盐酸的质量与生成CO 2的质量,得到两者之间的关系如图1、图2所示。(忽略CO 2在水中的溶解)
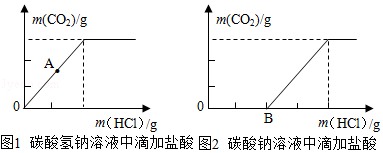
【合作交流】
(1)图1中A点时溶液中的溶质有 (填化学式);
(2)图2中从B点开始的变化关系与图1完全重合,据此我们可以判断碳酸钠溶液刚开始和稀盐酸确实发生了化学反应(如图OB段所示),请你写出该反应的化学方程式 。
【反思与评价】基于以上"异常"现象,你能提出的有价值的见解是 (任写一点)。
实验室利用如图实验装置进行有关化学实验,回答下列问题:

(1)写出标号仪器的名称:① ;
(2)实验室用高锰酸钾制取氧气,发生装置可选择图中的 (填字母),写出该反应的化学方程式 。该装置制取氧气有一处不足的地方,应如何改进: ;
(3)实验室制取二氧化碳的化学方程式是 ,用装置F收集二氧化碳,验满时,燃着的小木条应放在 (填"a"或"b")端。
某兴趣小组围绕"实验室制取氧气"进行了一系列探究活动:
(1)药品选择:下列物质中不能作为实验室制取氧气反应物的是 (填字母).
A.水 B.过氧化氢 C.氯化钾(KMnO 4)
原因是 .
(2)装置连接,所需的一些实验装置如图1所示:
仪器a的名称是 ;选择气体收集方法时,气体的下列性质:A.颜色 B.可燃性 C.溶解性 D.密度,必须考虑的是 (填字母);要制取并收集一瓶干燥的氧气,所选装置的连接顺序为 (填装置字母序号).
(3)气体检验:如图2甲装置中带火星的木条很难复燃,乙装置中带火星的木条较易复燃,原因是 .
(4)实验探究:如图3所示,向三支试管中分别滴加浓度相同的三种溶液,观察可见:实验①中无明显现象,实验②中产生气泡,实验③中产生气泡更快,据悉你能得出的结论是 .
请你根据如图回答有关问题:

(1)图一中仪器B的名称是 ;
(2)实验室欲制备并收集二氧化碳,需在图一中选用A、B与 (填序号)组合,该反应的化学方程式为
(3)图二是两套干燥气体装置,可用于干燥二氧化碳的是 (填"甲"或"乙"),不能选择另一套的原因是 。
如图所示,是为了验证稀硫酸化学性质所做的三个实验,回答下列问题。

(1)A实验最终能观察到的现象是 ;
(2)B实验能体现出稀硫酸具有的化学性质是 ;
(3)C实验中发生反应的化学方程式为 ;
(4)将上述实验后所得溶液在烧杯中混合,观察到烧杯底部有沉淀,上层为有色溶液,此时,利用烧杯中的沉淀,再选择适当的试剂,即可证明C实验中所加BaCl 2溶液过量,实验的操作及现象是 。
氧化铁是一种重要的化工原料,利用废铁屑(其中的杂质不溶于水,且不与酸发生反应)制备氧化铁的流程如图所示:
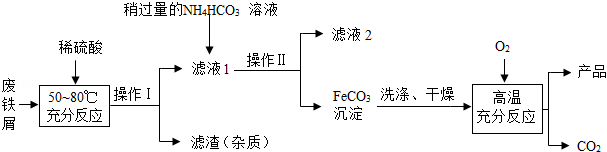
(1)操作Ⅰ、Ⅱ的名称是 ;
(2)向废铁屑中加入的稀硫酸需过量,其目的是 ;
(3)高温条件下,FeCO 3与通入的O 2发生反应的化学方程式是 。
如图所示是实验室制取气体的常用仪器,回答下列问题。

(1)标号为e的仪器名称是 。
(2)用2KMnO 4 K 2MnO 4+MnO 2+O 2↑制取 O 2,并用向上排空气法收集。
①若制取3.2gO 2,理论上至少需要KMnO 4 g;
②检验O 2收集满的方法是 ;
(3)用大理石和稀盐酸反应制取CO 2,并用排空气法收集;
①该反应的化学方程式为 ;
②组装制取装置时,需选择上图中的a、b、h、i、j、m和 。
2016年5月31日是第29个世界无烟日,世卫组织确定的主题是"为平装做好准备",我国的活动主题是"拒绝烟草的危害"。香烟的烟气中含有几百种有毒物质,其中的一氧化碳能与血红蛋白结合,可能导致人体缺氧窒息。血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白等的辅基,其分子式是C 34H 32N 4FeO 4.请回答下列问题:
(1)血红素中C、H、O、N、Fe五种元素的原子个数比是 。
(2)经测定血红蛋白中铁的质量分数为0.335%,每个血红蛋白分子中含有n个铁原子,则血红蛋白的相对分子质量可用含n的代数式表示为 。(不必化简)
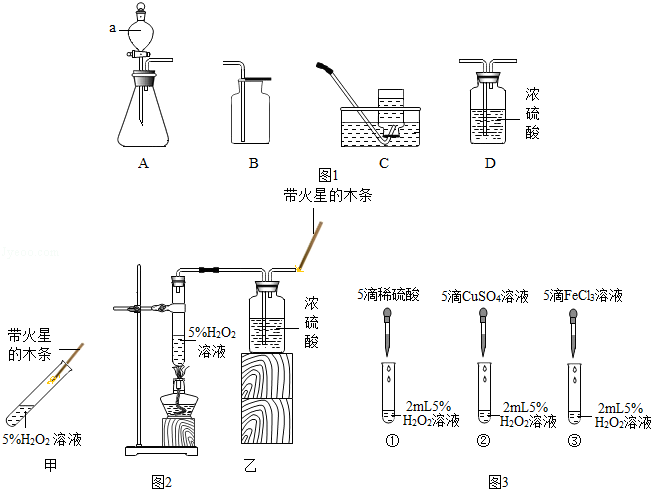
华雪同学在老师的指导下从图中选择装置在实验室进行氧气的制备实验。

(1)华雪同学首先选择装置A和E用加热高锰酸钾的方法制取氧气。
①装置A和E的导管口之间要用 连接。(填实验用品)
②不用D装置收集氧气的原因是 。
③当反应不再进行时停止加热,待试管冷却后洗涤试管,可看到溶解残留固体的洗涤用水呈现绿色(已知MnO 2不溶于水),说明 (填离子符号)在溶液中呈绿色。
(2)华雪同学然后选择装置B和C用分解过氧化氢的方法制取氧气。
①写出仪器a的名称: 。
②实验证明MnO 2、CuSO 4溶液、FeCl 3溶液等对过氧化氢的分解具有催化作用。已知FeCl 3在水中可解离处Fe 3+和Cl ﹣,请设计实验证明:FeCl 3溶液中对H 2O 2的分解真正起催化作用的是FeCl 3溶液中的Fe 3+. 。
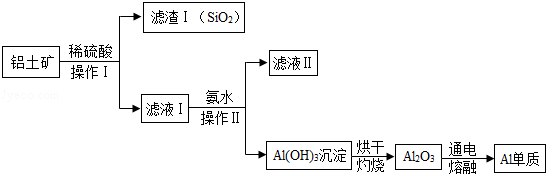
铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al 2O 3和SiO 2,不考虑其它杂质)制取金属铝的基本流程如下:
已知:①SiO 2是一种难溶于水,也不与盐酸、硫酸反应的物质。
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
请回答下列问题:
(1)Al 2O 3与稀硫酸反应的化学方程式为 。
(2)操作Ⅱ的名称是 。
(3)滤液Ⅱ中溶质的用途之一是 。
(4)电解熔融的Al 2O 3,除得到金属铝之外,还可得到的气体产物是 (填化学式)。
工业上电解熔融的Al 2O 3时,还加入了冰晶石(Na 3AlF 6)作熔剂,其作用是降低Al 2O 3的熔点,冰晶石在物质中的分类属于 (填字母)。
A.酸B.碱C.盐D.氧化物
试题篮
()