化学来源于生活,同学们对生活中的一些现象产生兴趣,在老师指导下开展了系列探究实验活动:
活动一:红砖粉末能做催化剂吗?
实验步骤 |
实验现象 |
实验结论和解释 |
|
小明 |
A试管装有5mL的5%过氧化氢溶液 B试管装有5mL的5%过氧化氢溶液,再加入a克的红砖粉末。 |
A中无明显现象,B中产生大量能使带火星的木条复燃的气体。 |
(1)产生的气体是 。 (2)红砖粉末能改变过氧化氢的分解速率。 |
小红 |
待反应停止时,向B试管中重新加入5%的过氧化氢溶液。 |
(1)又产生大量能使带火星的木条复燃的气体。 |
红砖粉末的 在反应前后没有发生变化。 |
【实验反思】小明和小红通过上述实验,一致认为红砖粉末可以做分解过氧化氢溶液的催化剂,但小强认为小明和小红说法不严谨,理由是 。
活动二:水壶内部的白色固体是什么?
【查阅资料】水在加热或长久放置时,溶于水中的可溶性钙和镁的化合物会生成沉淀(水垢)。
【假设与猜想】
猜想Ⅰ:CaCO3
猜想Ⅱ:Mg(OH)2
猜想Ⅲ: (填化学式)
【实验与探究】取少量白色固体样品(不考虑杂质和微溶物对实验的影响)于试管中,向其中加入足量稀盐酸,现象:白色固体溶解,有气泡产生,根据以上现象,小华认为:猜想Ⅰ正确。小雪却认为小华的结论不严谨,经过两人反复讨论,进一步设计了如表实验。
实验步骤 |
实验现象 |
实验结论 |
取上述实验中的上层清液于试管中,滴加足量NaOH溶液 |
|
猜想Ⅰ成立 |
有白色沉淀产生 |
猜想Ⅲ成立 |
验证猜想Ⅲ成立时产生白色沉淀的反应化学方程式是 。
活动三:验证NaOH变质有方法?
【方法归纳】同学们通过实验探究,认为验证氢氧化钠变质可以从验证反应后的生成物入手,例如:加足量稀盐酸等出现气泡,加氯化钙溶液等出现白色沉淀等来判别;也可以通过反应过程中温度、压强等变化来判别。
【学科渗透】按如图所示装置进行实验。实验前U型管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U型管中的液面 。
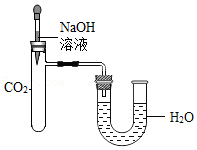
据此,小明同学得出“CO2与NaOH发生了化学反应”的结论。小红认为小明结论证据不充足,理由是 。
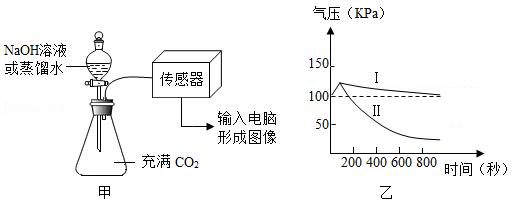
【再次实验】同学们用压强传感器研究水或等量NaOH溶液分别吸收CO2的效果,实验装置及测定结果如甲图和乙图所示。图乙中 (填“Ⅰ”“Ⅱ”)表示等量NaOH溶液吸收CO2的曲线。
古玩市场惊现"三星堆"遗址出土的同款黄金面具。某化学兴趣小组的同学为鉴别其真假进行了如下探究活动。
【查阅资料】
(1)铜锌合金(又称:假黄金)外观和黄金相似,常被不法商贩以假乱真。
(2)标准状况下,氢气密度ρ≈0.09g/L。
【进行实验】同学们设计了如下不同的探究方案,请帮他们完成实验报告。
| 方案 |
实验步骤 |
实验现象 |
| 一 |
截取小块黄金面具放在酒精灯上加热。 |
|
| 二 |
截取小块黄金面具于试管中,加入一定量稀硫酸。 |
有气泡产生 |
| 三 |
截取小块黄金面具于另一支试管中,加入适量氯化铜溶液。 |
|
【实验结论】该面具是假黄金。
【深入探究】为进一步定量分析黄金面具中金属锌的质量分数、小明同学利用上述方案二设计了如下实验:
Ⅰ、按如图所示组装实验装置,并 。

Ⅱ、向锥形瓶中加入5.0g黄金面具样品,注射器中吸入25mL稀硫酸。
Ⅲ、将注射器中的稀硫酸平均分5次推入锥形瓶中:每次推入稀硫酸、待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响),如表。
| 次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 收集气体的总体积/mL |
200 |
400 |
515 |
x |
525 |
(1)上表中的数据x= 。
(2)分析数据、完全反应后生成氢气的体积V= mL。
【数据处理】此黄金面具中锌的质量分数ω 1= 。
【反思评价】
(1)小红对小明的方案和数据处理进行分析,认为求黄金面具中锌的质量分数还有更简便的方法。她将锥形瓶内反应后的剩余物经系列操作: →洗涤→干燥→称量。得到固体剩余物的质量,也可求出黄金面具中锌的质量分数ω 2。
(2)鉴别黄金真假除以上化学方法外,还有许多物理方法:测密度、比较硬度等。
【表达交流】ω 1和ω 2有微小差异,小红对小明的方案和数据处理提出了质疑,认为自己的更准确。请说出小红质疑的理由: 。
某化学兴趣小组开展的氢氧化钠性质系列探究活动如图所示。

回答下列问题:
(1)实验①观察到氢氧化钠表面变 。
(2)实验②观察到紫色石蕊溶液变成 色,实验③观察到无色酚酞溶液变成 色。由此得出:碱溶液能使指示剂变色。
(3)实验④:
Ⅰ.当滴加稀盐酸至溶液呈中性时,溶液显 色;继续滴加稀盐酸并用玻璃棒不断搅拌,此时溶液中的溶质除酚酞外还有 (填化学式)。
Ⅱ.如图是氢氧化钠与盐酸反应的微观模拟示意图:
从微观的角度分析,甲、乙两处应填入的离子符号分别为 、 。
(4)实验⑤观察到的现象是 ,说明碱溶液能与某些盐反应。该反应的化学方程式为 。
(5)实验④⑤对应的化学反应,属于中和反应的是 (填数字序号)。
(6)实验⑥⑦为用软矿泉水瓶所做的对比实验,装 的软矿泉水瓶变瘪更明显,原因是 (用化学方程式表示)。

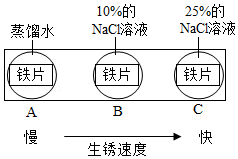
铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为 。
(2)铁锈主要成分是Fe 2O 3•nH 2O,铁生锈主要与空气中的 有关。
(3)如图实验说明NaCl在铁生锈中的作用是 。
(4)铁生锈的次要过程:Fe 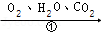 FeCO 3•nH 2O
FeCO 3•nH 2O  FeCO 3
FeCO 3
写出Fe转化为总反应的化学方程式 。
(5)为防止铁生锈,可对铁制品进行"发蓝"处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为 。
(二)废铁的再利用
黄钠铁矾[NaFe x(SO 4) y(OH) z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe 2O 3和FeCO 3)制备黄钠铁矾的主要流程如图:
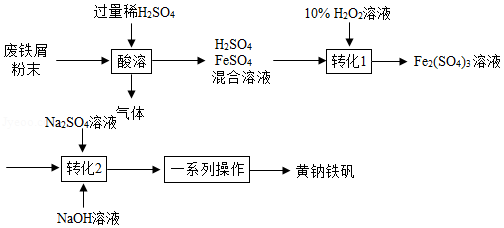
(1)将废铁屑研磨成粉末的目的是 。
(2)"酸溶"时H 2SO 4与Fe、FeCO 3反应,还发生反应的化学方程式有 和Fe+Fe 2(SO 4) 3=3FeSO 4。
(3)"转化1"发生反应的化学方程式为 。反应时温度不宜过高的原因是 。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用如图装置进行热分解实验。
【资料】
①NaFe x(SO 4) y(OH) z在T 1℃分解会生成H 2O(气态),提高温度至T 2℃继续分解产生SO 3气体,并得到Fe 2O 3和Na 2SO 4。
②浓硫酸可用于吸收SO 3。
(1)装配好实验装置后,先要 。
(2)分别控制温度在T 1℃、T 2℃对A中固体加热。
①控制温度在T 1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T 2℃,加热至反应完全。
③T 1℃、T 2℃时,加热后均通入一段时间N 2,目的是 。
(3)反应完全后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFe x(SO 4) y(OH) z中,x:y:z= 。
反思:若该实验过程中缺少C装置,则x:z的值 (选填"偏大""偏小"或"不变")。
某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe 2O 3)。用该废渣制取CaCl 2晶体(CaCl 2•xH 2O)并进行组成测定,其制取的流程如图1所示:
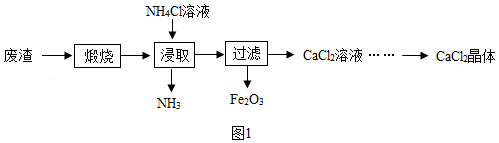
已知:NH 4Cl溶液显酸性,且浓度越高酸性越强
(1)XRD图谱可用于判断某固态物质是否存在。图2为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式 。

(2)浸取时需连续搅拌,其目的是 ;生成的NH 3能使湿润的红色石蕊试纸变 色。
(3)在其它条件相同的情况下,CaCl 2的产率随浸取温度的变化如图3所示。则宜选择的浸取温度为 ℃左右。
(4)若使用过量浓度较高的NH 4Cl溶液,则所得CaCl 2溶液中会含有NH 4Cl、 (填化学式)等杂质。
(5)过滤得到的Fe 2O 3在高温下可与CO反应,写出该反应的化学方程式 。
(6)测定晶体(CaCl 2•xH 2O)的组成:
a.称取14.7000g CaCl 2晶体于锥形瓶内,加入适量蒸馏水。使其全部溶解。
b.再向其中加入足量的Na 2CO 3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。 。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加 ,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值 (填"偏大"、"偏小"或"不变")。
结合如图所示所示实验,回答有关问题。

(1)有氨味的气体是 ;
(2)经检验,无色溶液C中含有NaCl,则可推测出X溶液为 溶液;
(3)进一步测定可知,无色溶液C的pH>7,向其中加入适量的Na 2SO 4溶液,无现象,写出无色溶液C中所含溶质的所有可能情况 。
生活中常见物质的性质、制法的是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 (填"单质"或"化合物")。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
(4)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物。

①B装置玻璃管里可观察到的现象为 。
②C装置中反应的化学方程式为 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na 2CO 3溶液呈碱性)
(5)工业上可利用"铝热反应"焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?

金属及其化合物是中学化学学习的重要内容。
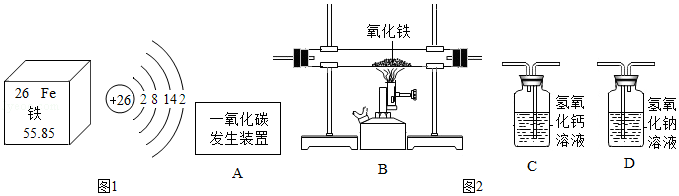
(1)据如图1信息判断,下列有关说法不正确的是 。
A.铁元素位于第四周期
B.铁原子的质子数为26
C.单质铁的化学性质比较活泼
D.铁元素的相对原子质量为55.85g
(2)利用如图2装置可做一氧化碳还原氧化铁的实验,并检验该反应生成的气体产物。已知由A装置制取的一氧化碳气体混有少量二氧化碳。
①要达到实验目的,装置从左到右的连接顺序为 。
②B装置玻璃管里可观察到什么现象? ,请写出有关反应的化学方程式 。
(3)为探究实验室废液的综合利用,某化学小组完成了如图3实验。
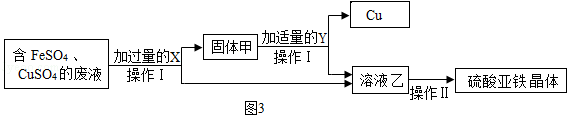
①Y为 ;加入X时反应的化学方程式为 。
②完成操作Ⅱ需进行以下操作:a.过滤;b.冷却结晶;c.加热浓缩;d.洗涤干燥。该系列操作的顺序为 (用字母代号表示)。
(4)高铁快速发展方便了人们的出行。工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。若用足量铝与48kg氧化铁反应,理论上可制得铁的质量是多少?
海尔蒙特、普利斯特利、萨克斯等多位科学家用了几百年的时间,经过无数次的实验才对光合作用有了比较清楚地认识,有许多关于"验证叶片在光合作用和呼吸作用过程中有气体的产生和消耗"的经典实验流传至今,现将其中一个实验的思路及过程简述如下:
(注:NaHCO 3稀溶液能维持溶液中CO 2浓度恒定.其原理是当CO 2浓度降低时,NaHCO 3稀溶液能释放CO 2,当CO 2浓度升高时,NaHCO 3稀溶液能吸收CO 2.)
①剪取一烟草叶片,立即将其放入盛有NaHCO 3稀溶液的容器中,发现叶片浮于液面;
②用真空泵抽去该叶片中的气体后,发现叶片下沉至容器底部;
③将该容器放在阳光下一段时间,发现叶片逐渐上浮
④再将该容器放在黑暗环境中一段时间,发现叶片又慢慢下沉至容器底部.
请你用所学的知识对以上③、④中叶片的上浮与下沉现象进行解释. 
科学课上,老师告诉学生“能发生复分解反应的两种盐通常是可溶的”.有“通常”就有“例外”,能否找到某些可溶性盐和难溶性盐发生复分解反应的证据呢?科学兴趣小组进行了探究.
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行.
②了解到某些难溶性盐的溶解能力和颜色.
3溶液,再加入过量NaCl溶液,有白色沉淀生成.
再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀.
【分析讨论】(1)为什么要加入过量的NaCl溶液?请说明理由.
(2)写出加入少量KI溶液后发生反应的化学方程式.
(3)该反应能发生的原因是AgI在水中的溶解能力 AgCl(选填“大于”、“等于”或“小于”).
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应.
小明取酸性锌锰干电池进行研究,他发现电池内部结构如图1所示。

【查阅资料】(1)锌皮为金属锌(含有少量的铁)
(2)黑色糊状填充物由炭黑、MnO2、ZnCl2和NH4Cl等组成
(3)有关数据见下表
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
|
【实验探究一】小明取适量黑色糊状填充物,按如图2所示实验流程进行探究。
(1)溶液A中溶质主要有 (填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是 。
(2)欲从固体M中得到较纯的MnO2,操作Ⅲ可采用简便方法是 。
【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成。
①实验中可观察到的现象是 ;该反应属于基本反应类型中的 反应。
②下列各组物质混合后,也能生成ZnCl2的有 (填字母序号)。
A.ZnO与稀盐酸
B.ZnSO4溶液与BaCl2溶液
C.ZnCO3与NaCl溶液
D.Zn(NO3)2溶液与NH4Cl溶液
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F.当溶液E中只含有一种溶质时,该溶质是 (填化学式);当固体F中只含一种物质时,溶液E中最少含有 种溶质。
(3)若将6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量 0.2g(选填“<”、“=”或“>”)。
兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
| 液体名称 |
蒸馏水 |
碳酸氢钠溶液 |
碳酸钠溶液 |
氢氧化钠溶液 |
| 紫甘蓝汁液显示的颜色 |
蓝紫色 |
蓝色 |
绿色 |
黄色 |
查阅资料:
| pH |
7.5~9 |
10~11.9 |
12~14 |
| 紫甘蓝汁液显示的颜色 |
蓝色 |
绿色 |
黄色 |
【得出结论1】三种溶液的碱性由强到弱的顺序为 。
【实验探究2】甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由 色变为 色。向其中加入稀盐酸,该反应的化学方程式为 。
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示。a点表示的意义是: 。
【得出结论2】从微观角度分析,该反应的实质是 。
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。
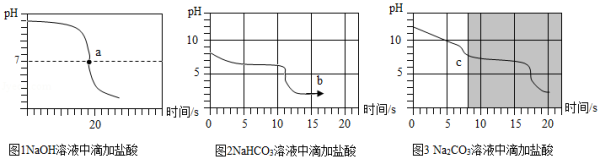
【交流与反思】b点的溶质为 (写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质 (写化学式)
【得出结论3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示: 、 。
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程。
水是生命之源
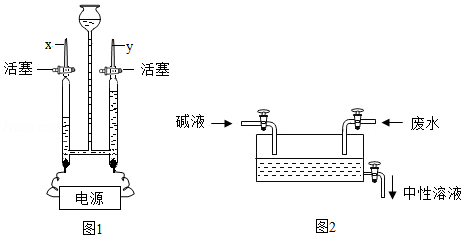
(1)如图为电解水的装置图,接通电源观察到两电极都有气泡产生,通电一段时间后,x玻璃管中收集到的气体是 。
(2)含有较多钙、镁离子的天然水称为硬水,生活中常用 来区分硬水和软水;自来水厂对天然水进行净化的过程中,通常不会采用 (填序号)
a.电解 b.吸附 c.消毒
(3)某工厂排放的废水中含有NaOH,在废水流量不变的情况下,用溶质质量分数相同的稀硫酸和稀盐酸(两种酸液的密度相同)来处理,通过调节流量阀来控制酸液的流量(Q),使最终排出的溶液呈中性(如图2),两种酸溶液的流量大小关系是:Q(稀硫酸) (填“>”“=”或“<”)Q(稀盐酸)
(4)将天然气(主要成分CH4)与水在高温、有催化剂的条件下转化为氢气和二氧化碳。写出该反应的化学方程式 。
同学们利用如图所示的装置,对质量守恒定律进行了探究。实验结束后,老师另外提出了几个问题,请你一起参与思考。
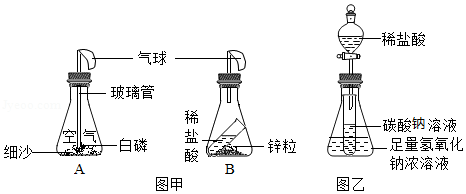
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是 (选填“A”、“B”或“A和B”)
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是 (选填序号)
①原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是多少?
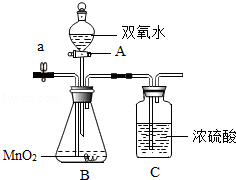
实验室新购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计如图所示的装置,其实验的操作步骤如下:
①组装仪器,并检查装置的气密性;
②在A、B、C三个仪器中装入药品,其中双氧水溶液质量为50g;
③用电子秤称量出整套装置的总质量为498.6g;
④关闭a处止水夹,打开A仪器的阀门,向锥形瓶中加入全部的双氧水溶液,随即关闭A仪器的阀门;
⑤充分反应后,打开a处止水夹,向装置中持续缓慢地鼓入X气体;
⑥第二次称量整套装置的总质量为497g。
(1)本实验采用的装置中,A仪器的名称是
(2)为尽可能减小测量误差,请结合测量原理判断,操作⑤中鼓入的X气体是 。
A.氦气 B.经干燥处理的空气 C.除去氧气后的空气
(3)根据题意,计算双氧水溶液中溶质的质量分数,写出计算过程。
试题篮
()