连云港海洋资源丰富,应用前景广阔。
(1)海水晒盐。如图是利用海水提取粗盐的过程:

①“蒸发池”中质量逐渐减少的物质是 (填化学式)。
②实验室里除去粗盐中难溶性杂质一般步骤为溶解、过滤、蒸发,这三种基本操作中都要使用的玻璃仪器是 。
③析出晶体后的“母液”是氯化钠的 (选填“饱和溶液”或“不饱和溶液”)。母液中含有 ,向母液中加入澄清石灰水有白色沉淀生成,该复分解反应的化学方程式为 。
(2)海底探物。海底埋藏着大量的“可燃冰”,其主要成分是甲烷水合物(由甲烷分子和水分子组成),还含有少量的 等气体。
①下列说法正确的是 (填字母)。
a.可燃冰和干冰都属于混合物
b.可燃冰与煤相比是较清洁燃料
c.可燃冰和石油都属于可再生能源
②利用 和 进行催化重整制氢气,反应前后分子变化的微观示意图如图所示。其中“乙→丙”发生反应的化学方程式为 。
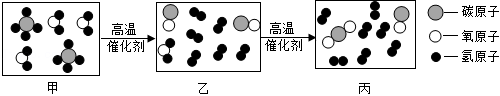
2022年北京成功举办冬奥会,化学功不可没。
(1)冬奥会环保人员的服装面料是利用回收废弃的塑料瓶加工制成。
①塑料属于 (填字母)。
| A. |
a.金属材料 |
| B. |
b.复合材料 |
| C. |
c.合成材料 |
②回收废弃塑料可缓解 (填字母)。
| A. |
a.酸雨 |
| B. |
b.白色污染 |
| C. |
c.温室效应 |
(2)冬奥会火炬“飞扬”首次采用液氢作燃料。关于氢气液化的过程说法正确的是 (填字母)。
| A. |
a.氢分子的体积变小 |
| B. |
b.氢分子间的间隔变小 |
| C. |
c.氢分子的数目变少 |
(3)冬奥会上提供经过二氧化氯消毒处理的直饮水。
①二氧化氯的化学式为 。
②证明该直饮水是软水的实验方案为 。
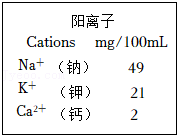
(4)冬奥会为运动员提供的某运动饮料包装标签部分说明如图。其中能预防骨质疏松、佝偻病的阳离子是 (填离子符号)。
阅读下面短文,回答问题。
铁是生活中使用最广泛的金属,活泼性较强,铁元素属于人体必需微量元素之一。
我国在春秋时期就开始了铁的冶炼,汉代出现了最早的炼铁高炉。
“苟利国家生死以,岂因祸福避趋之。”林则徐修筑洪泽湖大堤,所展现出的勤政爱民、甘于奉献是其一生赤子情怀的缩影。林则徐用生铁铸成铁锅(如图1),放在条石的齿槽之间,再浇上由糯米汁与熟石灰搅拌而成的砂浆,使得条石与条石牢牢地黏合在一起,不留丝毫缝隙,做到了针插不进、水泼不进。他还在每一块铁锔上刻上自己的名字,以表示对其修筑的工程终身负责。如今一百九十多年过去了,洪泽湖大堤依然固若金汤。
(1)人体缺乏铁元素,会影响健康,易得 (填序号)。
A.佝偻病
B.贫血症
C.甲状腺疾病
(2)工业上用赤铁矿石(主要成分: )冶炼生铁, 与 反应的化学方程式是 。
(3)利用铁锔和砂浆将条石与条石牢牢黏合在一起,使大堤固若金汤。
①说明铸造铁锔的生铁具有的物理性质是 。
②砂浆中的熟石灰与空气接触,发生反应的化学方程式是 。
(4)从条石中取出的铁锔暴露在空气中一段时间后,表面因生锈而腐蚀。导致铁腐蚀的因素有多种,化学兴趣小组同学对此开展以下探究:取四份质量均为0.15g的生铁粉末,分别放入如图2所示装置中进行四次实验。内容记录如下表所示:
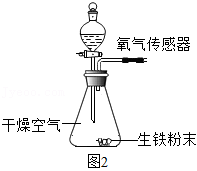
|
序号 |
实验操作 |
3分钟时氧气的含量 |
|
Ⅰ |
/ |
21% |
|
Ⅱ |
打开分液漏斗活塞,滴加2mL蒸馏水,关闭活塞 |
15% |
|
Ⅲ |
打开分液漏斗活塞,滴加2mL食盐水,关闭活塞 |
8% |
|
Ⅳ |
打开分液漏斗活塞,滴加2mL溶质质量分数为10%的稀盐酸,关闭活塞 |
13% |
①由实验Ⅱ、Ⅲ可知,加速铁生锈的物质是 。
②能说明铁生锈需要水的证据是 。
③实验Ⅳ中氧气含量下降的原因可能是 。

一种以甲烷为燃料、含铜氧化物为载氧体的化学链燃烧反应原理如下:

(1)科学利用燃烧为人类服务,有利于社会可持续发展。
①甲烷燃烧时, (填“吸收”或“放出”)热量。
②与传统燃烧方式相比,化学链燃烧可避免燃料和空气直接接触,有利于捕集 ,防止其大量排入空气,造成 。
(2) 进入燃料反应器与甲烷发生反应 ,生成的 再进入空气反应器,在一定温度下发生反应 (填化学方程式),实现载氧体的循环再生。
(3)已知:空气中 的体积分数约为21%。
从空气反应器排出的气体中 体积分数随反应温度变化关系如图所示。
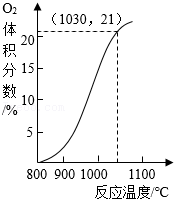
①在800~1100℃间,升高温度,排出的气体中 体积分数 (填“增大”或“减小”)。
②空气反应器中最适宜的反应温度范围是 (填序号)。
A.800﹣900℃
B.900﹣1000℃
C.1000﹣1030℃
D.1030﹣1100℃
涂覆在铺路石表面的 可净化路面空气。实验室制备 的流程如下:
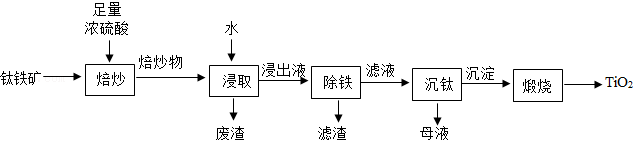
(1)焙炒时,钛铁矿的主要成分 在蒸发皿(如图)中发生反应 。实验中用沙浴加热,图中还缺少的玻璃仪器是 。

(2)焙炒物冷却后,加水溶解浸取。
①浸取时,水温易升高的原因是 。
②浸取后,混合物经 (填操作名称)弃去废渣,得到浸出液。
(3)浸出液除铁后,所得滤液中含 和 。
加热煮沸滤液, 和水反应生成 沉淀和 ,该反应的化学方程式为 。
(4)煅烧 沉淀得产品 。
整个实验流程中可循环利用的物质除水外,还有 。
某化工公司用硫酸钙( )、 、 、 制备化肥硫酸铵[ ],其工艺流程如下:
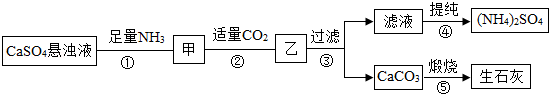
已知: 是一种极易溶于水且能与水反应的气体; 。
请回答下列问题:
(1) 是一种 (填“氮肥”“磷肥”“钾肥”或“复合肥”)。
(2)第③步的操作中,要用到的玻璃仪器有漏斗、 等。
(3)第⑤步的化学方程式为 。
(4)上述流程中,能循环使用的物质是 。
(5)长期施用硫酸铵化肥,会使土壤酸化、板结,不利于农作物生长,我们可以将适量的 加入土壤,以中和其酸性。
请用所学的知识回答下列问题:
(1)做铁钉与盐酸反应的实验时,“将铁钉放入试管”应如何操作?
(2)合成材料的应用与发展,大大方便了人类的生活。但由废弃塑料带来的“白色污染”导致了严重的环境问题。为减少“白色污染”,你认为应采取哪些措施?(至少答出一条)
诗人陆游的笔记中记载的省油灯如图所示,省油灯用棉线做炷(灯芯),上层盏盛油,下层盏盛水。请回答下列问题:
(1)省油灯燃烧需满足哪些条件?
(2)如不慎将燃着的油灯碰倒并导致桌面起火,你该如何处理?

金属在生活中随处可见,合金是用途广泛的金属材料。请回答下列问题:
(1)“一元”硬币的材质为钢芯镀镍,内芯是不锈钢(属于铁合金)合金属于 (填“纯净物”或“混合物”)
(2)制造硬币时,选择合金材料需要考虑哪些因素?(任答一点)
(3)金属矿物的储量有限且不能再生,保护金属资源的措施有哪些?任答一点)
我国化学家侯德榜曾为纯碱工业技术发展作出了杰出贡献。某同学绘制了包括纯碱在内的初中化学常见物质A~H间的关系图(如图)。已知A是碳酸钠,俗名叫纯碱,D和E反应后溶液呈蓝色,D、E、F是不同类别的物质。图中“一”表示物质间能发生化学反应,“→”表示物质间存在一步可以实现的转化关系(部分反应物、生成物和反应条件未标出)。据此回答下列问题:
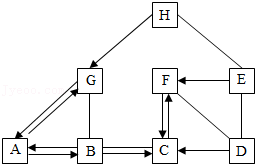
(1)物质A的化学式是 。
(2)F和D反应所属的基本反应类型是 。
(3)B和C反应的化学方程式是 。
小明同学取镁、铝、锌三种金属,分别放入盛有质量和质量分数都相等的稀盐酸的锥形瓶中,实验装置如图1,采集数据,得到如图2所示的气压变化曲线。
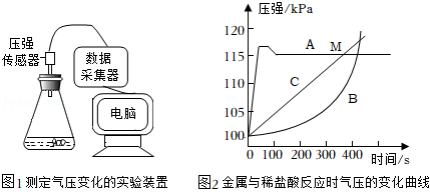
(1)镁、铝、锌与稀盐酸反应产生的相同气体是 (填化学式)。
(2)铝对应的曲线是B,反应速率先慢后快,其主要原因是 。
(3)从图2分析,以下结论正确的是 (填序号)。
①金属镁对应的气压变化曲线是A
②M点时参加反应的镁锌质量相等
③实验时取用的镁铝质量可能相等
《天工开物》是我国古代一部科技巨著。书中介绍了锌的冶炼方法:将炉甘石( )和煤炭饼装入炼锌罐,泥封后其底铺薪,发火煅红,制得锌后“冷定毁罐取出”。以下是模拟该过程的流程图。
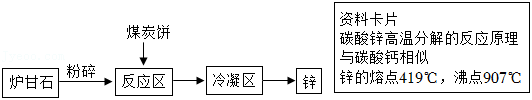
(1)流程中“粉碎”属于 变化(填“物理”或“化学”);
(2)反应区内碳酸锌高温分解的化学方程式为 ;
(3)冷凝区中将气态锌转化成液态锌,理论上该区应控制的温度范围是 ;
(4)“冷定”后方能“毁罐”取出,从化学变化角度解释其原因是 。
金属材料被广泛应用于生活生产中。
(1)下列物质不属于金属材料的是 。
A.钨丝
B.不锈钢
C.青铜
D.赤铁矿
(2)铜用作导线主要利用铜良好的延展性和 性。
(3)钠钾合金在室温下为液态,其熔点为﹣11℃,钠的熔点为97.8℃。钾的熔点为63.5℃。比较钠钾合金与钠、钾熔点的差异。得出的合理结论是 。
(4)普通黄铜是由铜、锌两种金属制成的合金。欲验证黄铜中铜、锌化学性质未发生改变(不考虑其他杂质),某兴趣小组进行了以下正验。
①取打磨过的20g含锌量为32.5%的黄铜样品,加入 产生气泡,溶液呈无色,并测得反应后的气体质量为0.2g和紫红色固体质量为13.5g,由黄铜中锌的化学性质未改变。
②取黄铜样品在酒精灯上灼烧,固体表面变黑,由此验证黄铜中铜的化学性质未改变。经讨论,仅根据固体表面变黑就得出结论,证据不充分,还需补充的实验方案是 (资料:氧化锌为白色固体,酒精的化学式为 )
(5)我国是世界上最早使用湿法炼铜的国家,其主要原理是将铁放入硫酸铜溶液中把铜置换出来,该反应的化学方程式为 。当铁与硫酸铜恰好完全反应时,反应前后溶液中未发生改变的主要微粒是 。
水是一种重要的自然资源。
(1)从物质变化的角度分析,自然界中水的三态变化属于 变化。
(2)自然界中的水通常是混合物,不同领域对水质的要求不同。生活中软化硬水常用的方法是 。
(3)地球上的淡水仅占总水量的2.53%。节约用水,人人有责,请列举一种生活中节约用水的做法: 。
(4)水是最常见的溶剂。一定浓度的硫酸铜溶液能用于游泳池消毒、配制农药波尔多液等,现需配制100g8%的硫酸铜溶液,根据如图提供的试剂,拟定一个配制方案:
(写出所选试剂和用量即可)。

(5)硝酸钾和硝酸钠的溶解度曲线如图一所示,现有80g硝酸钾和80g硝酸钠固体,分别置于两只烧杯中,再分别加50g80℃的蒸馏水,恒温条件下充分搅拌、静置,再冷却至20℃。两只烧杯80℃溶解后的现象和20℃时结晶现象如图二所示。(忽略液体体积变化)

①上述配制的硝酸钾和硝酸钠溶液在40℃时溶质质量分数较大的是 。
②图二中,盛硝酸钾的烧杯在80℃和20℃时的现象是 。(选填字母序号)
为使无明显现象的化学反应“可视化”,某兴趣小组的同学开展了下列实验。
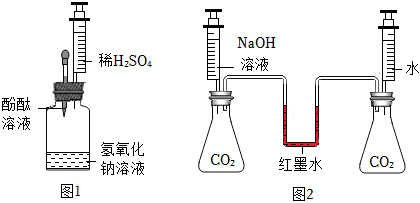
I.按图1进行实验,使氢氧化钠与硫酸反应“可视化”。
(1)滴入几滴酚酞溶液,溶液变红,说明氢氧化钠溶液pH 7(填“>”、“=”或“<”)。
(2)将稀硫酸缓慢注入瓶中并振荡,观察到红色褪去,说明氢氧化钠与硫酸发生了反应,此时瓶中溶质(酚酞除外)一定有 。
Ⅱ.按图2进行实验,使氢氧化钠与二氧化碳反应“可视化”。
(3)将注射器中相同体积的 溶液和水同时注入锥形瓶中,观察到 现象,说明氢氧化钠与二氧化碳发生了反应,反应的化学方程式为 。
Ⅲ.进行下列实验,使氢氧化钠与盐酸反应“可视化”。
查阅文献得知:① 溶解于乙醇的速率较慢,20℃时其在乙醇中的溶解度为14g/100mL;②乙醇密度为0.8g/mL;③氯化钠难溶于乙醇。
(4)20℃时,用小烧杯称取2.0g 固体,加入50.0mL乙醇,用玻璃棒不断搅拌约20分钟,静置,烧杯底部有少量固体,此时上层清液为 (填“饱和”或“不饱和”)溶 液。20℃时, 的乙醇饱和溶液中溶质质量分数为 (保留到0.1%)。
(5)取按下表比例配制的乙醇—蒸馏水混合溶剂各20.0mL于三只烧杯中,分别加入 固体搅拌,至有固体未溶解时,停止加入 。
|
烧杯编号 |
乙醇体积:蒸馏水体积 |
溶解 的质量/g |
|
① |
4:1 |
1.1 |
|
② |
3:1 |
1.4 |
|
③ |
1:1 |
3.1 |
分析上表数据,可得出的结论是 。
在上述三只烧杯中均加入10.0mL相同浓度 的乙醇溶液。搅拌并静置后,发现三只烧杯中均有固体,说明氢氧化钠与盐酸发生了反应,且烧杯③中固体最少,主要原因是 。
【总结反思】对于没有明显现象的化学反应,为了证明反应的发生,可以借助指示剂、 、测量温度变化、借助传感器等,提供间接的实验证据。
试题篮
()