右图表示的是将盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图。请回答:
(1)写出该反应的化学方程式 ,该反应的基本反应类型是 。
(2)从图中可看出该反应的微观本质是 。
水是人及一切生物生存所必需的,为了人类和社会经济的可持续发展,我们应该了解一些有关水的知识。请你回答:
(1)取回水样,静置后过滤。在实验室里,过滤需要用到的玻璃仪器有烧杯、 和玻璃棒。
(2)若过滤后所得的液体仍有浑浊,写出其中一种可能原因 。
(3)水是一种最重要的溶剂。将下列生活中的调味剂分别加入水中,用玻璃棒不断搅拌,不能形成溶液的是_______(填写字母)。
| A.食盐 | B.白醋 | C.蔗糖 | D.芝麻油 |
(4)漂白粉可用于水的杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙中氯元素的化合价是 ,次氯酸钙属于 (填“酸”、“碱”、“盐”、“氧化物”),计算次氯酸钙的相对分子质量 。
(5)饮用酸碱度过大或硬度过大的水都不利于人体健康,某化学课外活动小组用pH试纸测定所取水的酸碱度,正确的操作是 。
(6)水是一种重要的反应物。氢化钙(CaH2)固体是登山队员常用能源提供剂。用它与水反应生成氢氧化钙和氢气(提供燃烧之需),写出该反应的化学方程式 。
根据下面四个实验装置图回答问题: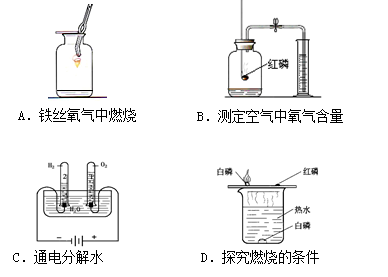
(1)在这些装置图中均有水出现,请说出水在这些实验中的主要作用:
A装置中集气瓶中的水 B装置中量筒中的水
C装置中水槽中的水 D装置中烧杯中的热水
(2)写出 B 装置中所发生反应的化学方程式
铁是生产、生活中应用广泛的金属材料。
(1)在酱油中加入铁强化剂,可预防 (填“佝偻病”、“贫血”或“骨质疏松”)。
(2)某种含铁粉的麦片,食用后在胃酸(盐酸)作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。
(3)对铁质零件进行“发蓝”处理后,其表面会形成致密氧化膜,从而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是________________。
②为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,由此可知“发蓝”处理效果不好,因为________________(用化学方程式表示)。
(4)某同学对X、银、铜、铁四种金属混合物的成分进行探究,流程如下: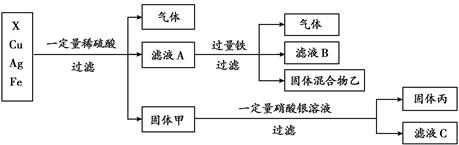
①四种金属的活动性由强到弱的顺序是 。
②固体丙的组成可能是 。
Ⅰ某同学用下图所示装置探究可燃物燃烧的条件,得到以下实验事实:
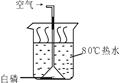
①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧。能证明可燃物必须达到一定温度(着火点)才能燃烧的实验事实是 。
Ⅱ某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:一周后观察:试管①和③中的铁钉无明显变化,试管②中的铁钉明显生锈。探究发现铁生锈的主要条件是铁与 直接接触,其中铁钉中的A、B、C三处中 处锈蚀最严重。试管①中加入的蒸馏水要事先煮沸,其目的是 。以上两个实验均采用的实验方法是 。
分析以下化学反应的微观示意图,并回答问题: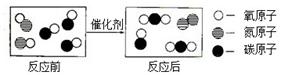
(1) 表示A物质的分子,则A物质的化学式为 。
表示A物质的分子,则A物质的化学式为 。
(2) 表示B物质的分子,B物质中碳、氧元素的质量比是 。
表示B物质的分子,B物质中碳、氧元素的质量比是 。
(3)该反应前后涉及到的化合物共有 种。
(4)参加反应的两种物质的分子个数比是 。
学校打算在草坪上造一座假山,用材是花冈岩和太湖石,请你用化学方法区分出这两种石头。经资料查阅得知:花冈岩主要成分为二氧化硅及铝硅酸盐,不能与稀盐酸反应生成气体;太湖石主要成分为石灰岩碳酸盐。
在课外小实验中,小强同学以废弃的"棒棒冰"塑料管为材料,制成的气体发生装置(如图所示)。请回答该实验设计的优点。(答出三点即可)

2020年9月,中国向世界宣布了2030年前实现碳达峰、2060年前实现碳中和的目标。
(1)为减缓大气中二氧化碳含量的增加,下列措施可行的是 (填序号)。
A.植树造林,开发和利用太阳能、水能、风能等新能源
B.禁止使用煤、石油、天然气等化石燃料
(2)绿色植物通过光合作用吸收二氧化碳,生成葡萄糖并放出氧气,其反应的化学方程式:6CO2+6H2O 葡萄糖+6O2,则葡萄糖的化学式为 。若吸收44g二氧化碳,理论上可释放出氧气 g。
葡萄糖+6O2,则葡萄糖的化学式为 。若吸收44g二氧化碳,理论上可释放出氧气 g。
(3)近年我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(CH3OH)和水,该反应的化学方程式为 。
(4)将一氧化碳和二氧化碳的混合气体3.2g通过足量灼热氧化铜粉末,充分反应,将所得的气体全部通入足量的氢氧化钡溶液中,气体全部被吸收,生成白色碳酸钡沉淀,溶液质量减少15.3g。则原混合气体中碳、氧元素的质量比为 (填最简比)。
A~F为初中化学常见的物质。D、E、F为不同类别的化合物,A是C通过绿色植物光合作用产生的气体,E是常用的食品干燥剂。它们的转化如图所示(“→”表示一种物质可以转化为另一种物质,部分反应物、生成物和反应条件已略去)。请回答。
(1)A物质是 。
(2)B物质所属的类别是 (填“单质”、“氧化物”、“酸”、“碱”或“盐”)。
(3)E→F的反应 (填“吸收”或“放出”)热量。
(4)F→D发生复分解反应的化学方程式为 。
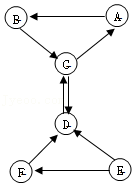
如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛。回答下列问题:
(1)A处澄清石灰水变浑浊了,写出这个过程发生的反应(用化学方程式表示)_____ ___
(2)B处紫色石蕊试液变红,这是因为( )
| A.二氧化碳使紫色石蕊变红 |
| B.水使紫色石蕊变红 |
| C.二氧化碳可使澄清石灰水变浑浊 |
| D.二氧化碳与水反应生成的碳酸使紫色石蕊变红 |
(3)C处出现的现象_____ ______;由此总结二氧化碳具有的性质:
①_____ _ _____;②_______ ____。
、
是生活中常见的盐,某实验小组通过以下实验来研究者离子物质的性质(已知:
、
的水溶液呈碱性;
受热易分解生成
、
和
).
(1)称取两种固体各1g分别放入两支试管中,再加入5mL水,振荡.固体充分溶解,并恢复至室温;
①发现
完全溶解,而
有剩余.由此得出结论:在相同温度下,;
②向所得溶液中各滴入1~2滴酚酞溶液后,溶液均呈 色。
(2)①取少量
按如图装置进行实验,可观察带的现象是:大试管口有水珠生成,;
②用的方法除去混在
粉末中少量的
。

(3)测定
样品(含
杂质)中
的质量分数:
①称取mg样品放入烧杯中加水溶解;
②加入过量的
溶液充分反应,反应的化学方程式为;证明反应后
有剩余的方法是;
③过滤、洗涤、干燥,称量测定的质量为ng.则样品中
的质量分数为.
如图所示:淀粉水解可产生某有机化合物A,A在不同氧化剂的作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原为D(C6H14O6)。B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。已知,相关物质被氧化的难易次序是RCHO最易,R—CH2OH次之, 最难。
最难。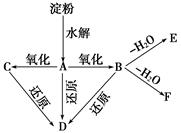
请在下列空格中填写A、B、C、D、E、F的结构简式。
A:____________________________________,
B:____________________________________,
C:____________________________________,
D:____________________________________,
E:____________________________________,
F:____________________________________。
实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题。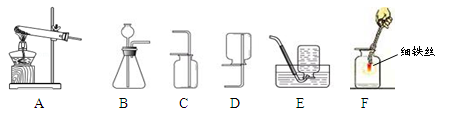
(1)写出实验室用A装置制取氧气的一个化学方程式 。
(2)若收集一瓶氧气,进行F的实验使用,最好选择气体收集装置中的___________(填装置
序号),理由是 。
(3)通过比较可以发现:实验室制取O2、H2和CO2的发生装置都可以选B,试写出满足选择B装置的一般条件__________________________。
(4)某同学称取了10g含杂质20%的石灰石与足量的稀盐酸反应,理论上可以制得二氧化碳的质量为
g(精确到0.1g)。
试题篮
()