下图是实验室中用于制取、干燥和收集气体的装置图。实验课上同学们用过氧化
氢溶液与二氧化锰混合制取并收集氧气,试回答:
(1)用该方法制取氧气的化学表达式是_____________________________________。
(2)该方法制取氧气的发生装置应选择__________ _。
_。
(3)甲、乙、丙三名同学用所选装置合作实验过程中,胶塞突然弹飞,并有少量的液体溅到实验台和衣服上。就此异常现象三名同学探究如下:
【问 题】为什么胶塞会突然弹飞呢?
【查阅资料】①容器内瞬间产生气体过多,压强过大,可能导致胶塞弹飞。
②化学反应速率与反应物的浓度、接触面积、温度、催化剂等因素有关。
【猜 想】甲同学:导气管堵塞或弯折造成的。
乙同学:过氧化氢溶液用量过多造成的。
丙同学:过氧化氢溶液的溶质质量分数过大造成的。
【分析验证】通过检查实验装置发现导气管没有堵塞、弯折的情况;与实验成功的小组同学交流,得知各小组所用过氧化氢溶液溶质的质量分数均相同。于是他们否定了_________________两名同学的猜想。请你设计实验,验证另一名同学的猜想是导致本次实验胶塞弹飞的主要原因。
【交流反思】①老师建议他们可以通过改进发生装置的方法,避免胶塞弹飞。你对所选的发生装置有何改进设想?(语言叙述或画图均可)
②实验结束后,有的同学发现衣服和手上出现有白色的斑点,手上还微微发痛。由此联想到过氧化氢溶液还可能具有 性。
水滑石化学式为:[Mg6Al2(OH)16CO3]•4H2O(相对分子质量为602),是环保型阻燃剂,它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
[查阅资料]水滑石与稀硫酸反应的化学方程式为:[Mg6Al2(OH)16CO3]•4H2O+9H2SO4=6MgSO4+Al2(SO4)3+CO2↑+21H2O,药片中除了水滑石外含有一定量的辅料﹣﹣淀粉等物质。
[提出猜想]小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
[设计方案]他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了如图所示的实验装置.取10.0g市售的水滑石药片研磨成粉末,进行实验。
[说明]碱石灰是氧化钙和氢氧化钠固体的混合物,B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀硫酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %.(写出计算过程)。
[方案评价]在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
现有银、铁、铜三种金属丝,为探究它们的金属活动性顺序,某同学设计了如下实验方案,请你根据他记录的相关信息,回答下列问题:
(1)填写下表"实验现象"
| 序号 |
实验步骤 |
实验结论 |
| 1 |
取铁丝浸入稀硫酸中 |
|
| 2 |
取铜丝浸入稀硫酸中 |
无现象 |
| 3 |
取银丝浸入硫酸铜溶液中 |
(2)三种金属的活动性由强到弱的顺序是;
(3)写出铁与稀硫酸反应的化学方程式.
某化学兴趣小组根据如图所示进行模拟炼铁的实验,并对产物成分进行探究.经初步分析:无色气体A不含有单质气体,黑色粉末B含有两种单质中的一种或者两种.高炉炼铁的原理为Fe2O3+3CO 2Fe+3CO2,请写出反应器中产生一氧化碳的化学方程式:________________________________________________________________________.
2Fe+3CO2,请写出反应器中产生一氧化碳的化学方程式:________________________________________________________________________.
兴趣小组又分成甲、乙两组分别对无色气体A和黑色粉末B的成分进行探究.
[猜想与假设]
甲组在分析了炼铁的原理后,认为无色气体A中可能有CO2,也可能有未反应的________.
乙组认为黑色粉末的成分中存在以下三种情况:
假设一:只含有铁.假设二:只含有________.假设三:以上两种物质都含有.
[实验探究]
(1)为验证甲组的猜想,大家按下图所示进行实验(箭头表示气体流向):
当看到Ⅰ中澄清石灰水变浑浊,Ⅲ中灼热的氧化铜变红,可以确定无色气体A的成分为________,Ⅱ中浓硫酸的作用是________________________.
(2)为验证乙组中假设三成立,大家用物理和化学两种方法来进行探究.
| 实验方法 |
实验操作 |
实验现象 |
实验结果 |
| 物理方法 |
|
|
假设三成立 |
| 化学方法 |
取少量黑色粉末B于试管中,加入过量的稀盐酸 |
|
假设三成立 |
写出黑色粉末B中加入过量的稀盐酸反应的化学方程式:________________________.
[交流反思]
在做甲组的实验时发现其存在一个很不环保的缺陷,请指出来________________.
以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验序号 |
过氧化氢溶液浓度、% |
过氧化氢溶液体积/ml |
温度/C |
二氧化锰的用量/g |
收集氧气的体积/ml |
反应所需的时间/s |
| 1 |
5 |
1 |
20 |
0.1 |
4 |
16.74 |
| 2 |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| 3 |
30 |
5 |
35 |
|
2 |
49.21 |
| 4 |
30 |
5 |
55 |
|
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;从实验③和④对比可知,化学反应速率与温度的关系是 ;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量 (选填“减小”或“不变”或“增大”).
某化学兴趣小组以A装置为核心装置设计了如图系列实验:(固定装置的仪器已省略)

按如图所示连接仪器,检查整套装置的气密性良好,添加药品,固定装置,进行实验。
(1)关闭K2,打开K1,将H2O2溶液缓缓滴入锥形瓶中,待D装置中出现连续均匀气泡时点燃C装置中的酒精灯,观察到V型管内a处的硫燃烧,现象是 ,试写出在D装置中反应的化学方程式 ,待V型管内的硫燃尽后仍要继续通一段时间的氧气,目的是 。
(2)打开K2,关闭K1,继续将H2O2溶液缓慢滴入锥形瓶,观察到装置E中
(填现象),说明氢氧化钠和稀盐酸一定发生了反应。
(3)兴趣小组有同学提出疑问:E装置内反应后的废液中除酚酞以外还有哪些溶质呢?请你一起参与探究。
【作出猜想】
猜想一:NaCl
猜想二:NaCl和NaOH
猜想三: 。
【分析】以上有一种猜想一定错误,请写出错误猜想的序号及错误理由 。
【资料】NaCl的水溶液呈中性。
【设计并进行实验】排除了错误猜想后,为了验证其余猜想,同学们进行了如下实验:
实验操作 |
实验现象 |
实验结论 |
取少量E装置中的废液于试管中,并向其中加入① 。 |
② |
猜想三正确 |
【交流反思】该废液未经处理不能随意倒入水池。
2021年全球新冠疫情形势依然严峻,除了打疫苗、戴口罩、勤洗手外,还需要科学、正确、安全地消毒。84消毒液、H2O2溶液都是常用的消毒剂,某兴趣小组对这两种消毒剂进行了如下探究活动:
【实验】取少量84消毒液置于试管中,滴加H2O2溶液,有大量气泡产生,经检验产生的气体是氧气;
【查阅资料】84消毒液的有效成分是次氯酸钠(化学式为NaClO);
【提出问题】在上述反应中,NaClO的作用是什么?
【作出猜想】
猜想一:NaClO类似分解H2O2溶液制取氧气时MnO2的作用,作催化剂;
猜想二:NaClO与H2O2溶液发生化学反应,作 ;
【实验探究】
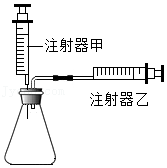
(1)按入图所示组装实验装置(固定装置省略),加入药品前的操作是 。
(2)实验Ⅰ:按入图装置经注射器甲注入10mL水,观察到注射器乙活塞向右移动10mL;(忽略大气压、摩擦等其他因素对测量结果造成的影响,下同)
(3)实验Ⅱ:先向锥形瓶中加入20mL 84消毒液,再按如图装置将25mL H2O2溶液平均分5次经注射器甲注入锥形瓶中,待注射器乙活塞不再向右移动后,记录每次气体的总体积,数据见表:
/ |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
H2O2溶液/mL |
5 |
5 |
5 |
5 |
5 |
注射器乙中气体的总体积/mL |
35 |
70 |
85 |
a |
b |
表中的数据a= ;
【实验结论】根据表中数据判断 (填“猜想一”或“猜想二”)是正确的,依据是 。
【反思评价】通过该实验说明消毒剂混用可能会影响消毒的效果,因此生活中在使用各种消毒剂时不能随意混用,应科学使用,注意安全。
炎热的夏季,游泳池成了人们消暑健身的热门场所,水质的安全也成为大家关注的话题。小丽和同学们对某室内游泳池的水呈蓝色的原因及水质安全展开了研究。请回答下列问题。
【查阅资料】
a.水对蓝光的反射和散射作用使水呈现蓝色,水越深,蓝色越明显。
b.游泳池的水质常规检验主要项目及限值如下表:
项目 |
浑浊度 |
pH值 |
尿素 |
总大肠菌群(36℃,24h) |
游离性余氯 |
化合性余氯 |
水温 |
数值 |
≤1NTU |
7.0﹣7.8 |
≤3.5mg/L |
每100mL不得检出 |
(0.2﹣1.0)mg/L |
≤0.4mg/L |
23℃﹣30℃ |
【交流与讨论】小丽认为泳池水呈蓝色可能是因为加入了硫酸铜。
【实验探究】
实验步骤 |
实验现象 |
实验结论 |
(1)取少量泳池水于试管中,加足量 溶液 |
无明显现象 |
泳池水中无Cu2+ |
(2)另取少量泳池水于试管中,加稀盐酸,再加足量 溶液 |
产生白色沉淀 |
泳池水中含有SO42﹣ |
【实验结论】泳池水的蓝色是水对蓝光的反射和散射作用引起的。从微观角度分析,水分子本身 (填“有”或“没有”)改变。写出一个步骤(2)中产生白色沉淀可能发生的化学反应方程式 。
【实验调查】同学们就泳池水净化问题走访了游泳馆的管理人员,得知:
a.泳池水通过循环净化的方式实现再利用,其工艺流程如图所示。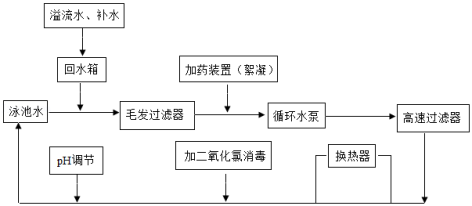
b.泳池水常见的水质问题是尿素含量超标。
(1)写出二氧化氯的化学式 。
(2)加药装置中絮凝剂的作用是 。
(3)提出一条降低泳池水中尿素含量的建议 。
果蔬洗盐既能去除水果和蔬菜表面的农药,又能杀菌、去小虫,近几年比较流行。某品牌果蔬洗盐常温下为白色固体,小敏取用时不小心将其洒落在天然气的火焰上,发现火焰呈黄色,这引起了小敏探究其成分的兴趣。
【查阅资料】1.钠及其化合物灼烧时火焰呈黄色。
2.农药大多数呈酸性。
【提出猜想】猜想一:碳酸钠
猜想二:碳酸氢钠
猜想三:碳酸钠和碳酸氢钠的混合物
小敏做出以上猜想的依据是 。
【查阅资料】碳酸氢钠受热分解产生二氧化碳、碳酸钠和水。
【进行实验】
实验步骤 |
实验现象 |
分析与结论 |
①取一定量果蔬洗盐加热至固体质量不再改变,将生成的气体全部通入足量澄清石灰水中 |
有气体生成,澄清石灰水中产生白色沉淀 |
生成气体的化学方程式: ,该品牌果蔬洗盐中含有 |
②将①加热后残留固体全部溶于水,加入足量氯化钙溶液 |
产生白色沉淀 |
/ |
③分别测量①和②产生沉淀质量 |
①中产生沉淀2.5g,②中产生沉淀质量 |
该品牌果蔬洗盐中含有碳酸钠 |
【继续探究】
小敏想到妈妈以前常用食盐水洗水果,猜想该品牌果蔬洗盐中还可能含有氯化钠。她向其水溶液中加入 至溶液呈酸性,再加入 溶液,观察到有白色沉淀生成,证明有氯化钠。
【拓展延伸】
该品牌果蔬洗盐不可直接食用,使用后,要用清水冲洗。
某校化学兴趣小组的同学在探究碱的化学性质时,完成了如图所示的两个实验。
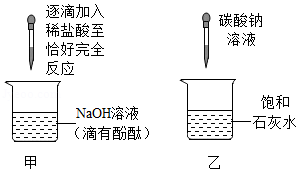
(1)甲实验中观察到的现象是 。
(2)乙实验中发生反应的化学方程式为 。
实验完毕后,小亮同学在整理仪器时,将上述实验后的废液倒入同一个洁净的废液缸中,发现混合后的废液仍然浑浊并显红色,于是引起了他的质疑和探究兴趣。
【提出问题】混合废液中可能含有的碱性物质有哪些?
【作出猜想】他断定混合废液中一定含有氢氧化钠,理由是 ;并对是否含有其它碱性物质作出猜想:猜想Ⅰ:Na 2CO 3 猜想Ⅱ:Ca(OH) 2
【实验验证】小亮认为只要用反应物(饱和石灰水和碳酸钠溶液)就可以验证猜想。于是他对混合废液进行过滤,并取少量滤液进行了下列实验:
| 实验操作 |
实验现象 |
实验结论 |
| M是 |
|
猜想Ⅱ不正确 |
| N是 |
|
猜想Ⅰ正确 |
【反思与交流】
验证完毕,小刚同学受到启发,于是他又设计了一个实验,进一步验证混合废液中含有的碱性物质。他取一定量的滤液于试管中,然后逐滴滴加稀盐酸至过量,反应过程和产生的现象如图所示。分析图象数据可以得出混合废液中含有的碱性物质一定是 。

【拓展应用】为了把以上废液安全排放,你的做法是 。
我校某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
①在集气瓶中加少量的水,将水面上方的空间分为5等份.
②在带橡皮塞和导管的燃烧匙内装入一定量的红磷,将导管上的弹簧夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.
③充分反应后,待集气瓶冷却至室温,打开弹簧夹.
请回答下列问题:
步骤②集气瓶中燃烧的主要现象是 ,其反应的文字表达式为 ;
步骤③中打开弹簧夹后观察到的现象是烧杯中的水沿着导管进入集气瓶的“1”处,由此可得出空气中氧气的体积约占 ;但本实验的结果是进入集气瓶中的水小于理论值,其原因可能是 ;
②中点燃红磷的方法有什么后果? _.

小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她设计并完成了下表所示的探究实验:
| |
实验操作 |
实验现象 |
实验结论或总结 |
|
| 结论 |
总结 |
|||
| 实验一 |
取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 |
有气泡产生,木条不复燃 |
过氧化氢分解产生氧气,但是速度慢 |
二氧化锰是过氧化氢分解的催化剂 |
| 实验二 |
|
有气泡产生,木条复燃 |
二氧化锰能加快过氧化氢的分解产生氧气。反应的文字表达式为: |
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是 。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量二氧化锰的质量,其目的是: 。
第二方面的实验探究:二氧化锰在化学反应前后的 。
某化学兴趣小组的四位同学对氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分进行了探究。
【作出猜想】小马猜想:溶质有NaCl、HCl、NaOH。
小程猜想:溶质只有NaCl
小宫猜想:溶质有NaCl、HCl
小尚猜想:溶质有NaCl、NaOH
(1)老师认为小马的猜想是错误的,其理由是_______________________________
【方案设计】小程和小宫分别设计如下方案验证各自的猜想。
| 方案设计者 |
方案步骤 |
方案预估现象 |
方案结论 |
| 小程 |
用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,把试纸所呈现的颜色与标准比色卡进行对照 |
pH=7 |
小程猜想正确 |
| 小宫 |
取少量反应后的溶液于一支试管中,再向试管中滴加稀硝酸和硝酸银溶液 |
有白色沉淀生成 |
小宫猜想正确 |
(2)两位同学中________________的方案正确。
【方案反思】
(3)请分析错误方案的原因:__________________________(若都正确,不作答)。
【拓展研究】
(4)请你再设计一个实验方案验证小尚的猜想正确,填写下列实验报告。
| 方案步骤 |
方案现象 |
方案结论 |
| 取少量反应后的溶液于一支试管中,再向试管中滴加________ 溶液 |
出现蓝色沉淀 |
小尚猜想正确 |
A、B、C是初中化学常见的液体、气体、固体,气球套在试管口且保证密封性能良好。

(1)若A能使紫色石蕊变红,B为空气,将固体C倒入试管中产生气泡,同时气球因膨胀而鼓起来。液体A,固体C可能是什么物质?请给出两种不同组合(C为不同类别物质),组合一:_________,化学方程式 ;组合二:_______,化学方程式_________。
某课外活动小组通过Internet网上资料得知: 废弃的定影液中含有一定量的AgNO3。他们从摄影店收集到一些废弃的定影液,准备将其中的银以单质的形式全部回收。于是进行了以下的实验活动。
(1)[设计方案]:①加入比银活泼的金属单质 ② 除去金属混合物中的杂质
(2)[小组讨论]:
①加入的金属:向定影液中加入过量铁粉,则得到的金属混合物中含银和铁。
②在这种方案中除去银粉中过量金属的方法:向金属混合物中加入适量的试剂_______。
(3)[进行试验]过程如下:
①废弃的定影液 金属混合物+溶液A
金属混合物+溶液A
②金属混合物 单质银
单质银
请问操作a是________,需要用到的玻璃仪器有:烧杯、玻璃棒、________;
(4)[产品验证]:请你设计一种简单方法验证得到的银中是否还含有铁粉,方法是 ____ 。
试题篮
()