根据下列物质之间的相互转化关系回答:
化合物甲+单质x→化合物乙+单质Y
(1)若乙的溶液是浅绿色,Y是红色固体,则该反应的化学方程式可表示为________________________.
(2)在常温下若乙是一种气体,则该反应的化学方程式可表示为________________________.
(3)若单质X是固体,单质Y是无色气体,则X是可以是________.写出其中一个反应的化学方程式:________________________________.
锅、铁、铜是我们生活中常见的金属.
(1)下列生活用品中,主要利用金属具有良好导热性的是________(填序号).
(2)铝具有很好的抗腐蚀性能,原因是________________________________________.
(3)在高温条件下,利用焦炭与氧气反应生成的一氧化碳可把铁从铁矿石里还原出来.某炼铁厂现用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是________t.(计算结果精确到0.1)
(4)工人师傅切割铁板时,用硫酸铜溶液在铁板上画线可留下红色的印迹,其反应的化学方程式为________________________________________________.
铁及其化合物在生活生产中有重要的应用.请回答下列问题:
(1)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是________________,为防止集气瓶破裂,常采取的措施是________________________________.
(2)已知铁能与氯化铁反应生成氯化亚铁.将生锈的铁钉(铁锈的主要成分是Fe2O3)放入盐酸中,充分反应后有铁剩余,写出发生置换反应的化学方程式:________________,溶液中的金属阳离子是________________(用符号表示).
(3)高炉炼铁中,焦炭的作用是________________________________________(用化学方程式表示).
(4)把铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后有固体剩余.下列说法正确的是________(填写字母序号).
| A.剩余固体肯定含有银 |
| B.剩余固体肯定是银和铜 |
| C.反应后溶液中一定有Fe2+和Cu2+ |
| D.反应后溶液中可能含有Ag+和Cu2+ |
观察一下我们的周围,就会发现金属的用途之广.
(1)根据图的应用实例,可知金属具有的物理性质有________________________________.
(2)在已经发现的一百余种元素中,金属元素的种类远比非金属元素的种类________;工业上用赤铁矿作原料炼铁的化学方程式为________________________________.
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生反应的化学方程式为________________________________.
(4)铁制品锈蚀的过程中,实际上是铁与空气中的________和________等发生化学反应的过程.生成的暗红色固体.其主要成分的化学式为________.请写出一条防止铁制品生锈的方法:________.
(5)铁丝在纯净的氧气中燃烧的化学方程式为________________________________.
实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液.配制步骤为:
(1)计算:需氢氧化钠固体________g,水________mL.(水的密度是1g/cm3)
(2)称量:用质量为23.1g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在________盘.在下表所列的砝码中,选出所需砝码(打“√”表示选用):
| 砝码/g |
100 |
50 |
20 |
20 |
10 |
5 |
| 打“√”表示选用 |
|
|
|
|
|
|
并在下列标尺中选出能正确表示游码位置的选项________(填字母).
(3)溶解:将氢氧化钠固体溶于水,用________搅拌,使氢氧化钠全部溶解,冷却至室温.
(4)装瓶:把配制好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中.
现有三支试管,分别加入不同温度和体积的水,试管编号及相关数据如下表:
| 试管编号 |
A |
B |
C |
| 水的体积/mL |
5 |
10 |
10 |
| 水的温度/℃ |
20 |
20 |
50 |
(1)向三支试管中各加入0.5g硫酸铜粉末,完全溶解,溶液颜色最深的是________;
(2)再向B、C两支试管中分别加硫酸铜粉末直至饱和,则B中溶液的颜色较C中的________;
(3)由此实验可得出:①溶液的浓度越大,有色溶液的颜色越________;②________________________________.
图是某同学配制一定质量、溶质质量分数为0.9%的生理盐水的全过程:
(1)请找出图中的错误:
①________________;②________________;③________________.
(2)如果配制的生理盐水中NaCl的质量分数小于0.9%,则可能造成误差的原因有(至少举出三点):①________;②________;③________.
根据图中A、B、C三种物质的溶解度曲线回答:
(1)A、B、C三种物质有可能为气体的是________.
(2)t1℃时,将等质量的A和B分别加入盛有等质量水的烧杯中,充分搅拌后,其中一个烧杯中仍有少量固体未溶解,则未溶解的固体是________.
(3)要在不改变溶液浓度的前提下使t2℃时B的饱和溶液成为不饱和溶液,可采用的方法是________________.
(4)现要配制t3℃时A物质的饱和溶液90g,需要A物质的质量为________.
苯甲酸是一种食品防腐剂,它是一种片状晶体,在一定量水中溶解的最大量随温度的升高而增大.下表是该物质在100g水中达到饱和时所能溶解的最大量.
| 温度/℃ |
25 |
50 |
95 |
| 达到饱和所溶解的质量/g |
0.17 |
0.95 |
6.8 |
某同学为提纯某一苯甲酸样品(其中含有泥沙等难溶于水的杂质),进行了如下实验:
(1)取样品约2g放入烧杯中,加入100mL蒸馏水充分搅拌,发现样品几乎没有溶解,原因是________________________.
(2)将烧杯放在石棉网上加热,待样品充分溶解后趁热过滤.趁热过滤的目的是________________.
(3)将所得滤液缓慢冷却至室温就可使苯甲酸以晶体形式析出,其原因是________________________________.
(天津)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题: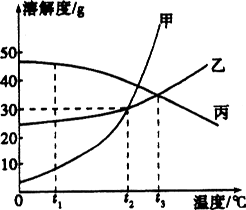
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是________;
(2)t2℃时,甲和乙的溶解度________(填“相等”或“不相等”);
(3)t2℃时,甲物质的饱和溶液中溶质与溶剂的质量比为________(写最简比);
(4)t3℃时,将乙和丙两种物质的饱和溶液降低到t1℃,所得溶液中溶质的质量分数大小关系为:乙________丙(填“>”“<”或“=”).
小明同学绘制了图所示A、B两种固体物质的溶解度曲线: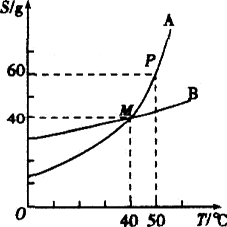
(1)当________℃时,A物质与B物质的溶解度相等.
(2)若将B物质从溶液中结晶析出,宜采用的结晶方法是________.
(3)我国有许多盐碱湖,湖水中溶有大量的NaCl和Na2CO3,那里的人们冬天捞碱,夏天晒盐,据此你认为图中(填字母)________物质的溶解度曲线与纯碱的溶解度曲线相似.
图是A、B、C三种固体物质的溶解度曲线.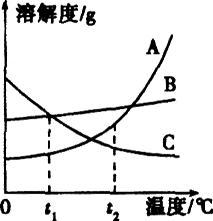
(1)随着温度的升高,溶解度减小的是________;
(2)t1℃时,B、C的________相等;
(3)t2℃时,要使接近饱和的A溶液变为饱和溶液,可采用的一种方法是________________.
将一块油污抹布分剪成相等的四块后,分别浸没在等质量的溶有少量洗涤剂的冷水和热水中,其中C、D分别再加同一牌子的洗涤剂各5滴,如图所示.
(1)10分钟后分别用小洗衣机洗涤20分钟,再用清水漂洗干净,并进行比较,________(填字母)中的抹布最干净,原因是________________________________________.
(2)由上述实验得到的启示谈谈在家清洗餐具时应如何做?________________________________.
学习溶液的知识后,可以帮助我们正确认识溶液的组成及物质的溶解过程,下表是几位同学对溶液的错误认识,请你用熟悉的实例来否定其观点.
| 序号 |
错误观点 |
否定实例 |
| (1) |
溶液一定是无色的 |
|
| (2) |
均一、稳定的液体一定是溶液 |
|
| (3) |
溶液中的溶剂一定是水 |
|
| (4) |
一种溶剂最多溶解一种溶质 |
|
| (5) |
两种液体混合后充分振荡,一定得到溶液 |
|
相信你会辨别:
写出下列溶液中的溶质、溶剂:
| 溶液 |
氯化钠溶液 |
高锰酸钾溶液 |
过氧化氢溶液 |
碘酒 |
澄清石灰水 |
盐酸 |
| 溶质 |
|
|
|
|
|
|
| 溶剂 |
|
|
|
|
|
|
由上(并结合书本)可知:
(1)________是最常见的溶剂.
(2)溶质状态可以是________________________.
(3)固体、气体与液体混合,________是溶剂.
液体与液体混合,有水的,水是________;无水的,量多的是________.
小窍门:可以根据________________辨别出溶质、溶剂.
试题篮
()