小英在做饭时发现很多因素都能影响食盐在水中的溶解速率.
(1)从你能想到的可能影响食盐在水中的溶解速率的因素中写出其中两项,并预测此因素对食盐的溶解速率的影响.
因素①________,你的预测________________________________;
因素②________,你的预测________________________________.
(2)从你所列的因素中选出一个,通过实验证明你的预测.
某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:
(1)一周后观察,试管①和③中的铁钉无明显变化,试管②中的铁钉明显生锈.探究发现铁生锈的主要条件是铁与________________直接接触,其中试管②中铁钉的A、B、C三处中________处锈蚀最严重.
(2)试管①中加入的蒸馏水要事先煮沸,其目的是________________________________.
(3)沙漠地区的铁制品锈蚀较慢的原因是________________________________.
为了研究炼铁原理,我市某校九年级综合实践活动小组按图所示用一氧化碳与氧化铁反应进行实验,现请你一起参与.
(1)该实验开始时,要先通一会儿一氧化碳再加热,其目的是________________________.
(2)硬质玻璃管内发生反应的化学方程式是________________________________________.
反应停止后,同学们对冷却后硬质玻璃管内固体物质的组成产生了兴趣,大家纷纷提出自己的猜想.请将你的猜想写出:
猜想一:________________________________________________________________.
猜想二:________________________________________________________________.
以下是某些金属与氧气发生反应的化学方程式:①4Al+3O2=2Al2O3②2Mg+O2 2MgO ③2Cu+O2
2MgO ③2Cu+O2 2CuO ④3Fe+2O2
2CuO ④3Fe+2O2 Fe3O4⑤Au+O2→不反应
Fe3O4⑤Au+O2→不反应
综合上述信息可知:
(1)大多数金属都能与________反应,反应难易程度________(填“相同”或“不相同”).
(2)铝在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?________________.
(3)为何不宜用钢刷来擦洗铝制餐具呢?________________________________________.
小明为探究Cu、Al、Ag的金属活动性顺序,做了以下两个实验.请分析实验,完成填空.
(1)试管①中观察到的现象是:铝丝表面附着一层________固体,溶液颜色变浅.
(2)试管②中发生了化学反应,现象明显.该反应的化学方程式是________________.
(3)通过实验探究,Cu、Al、Ag三种金属活动性由强到弱的顺序是________.
某兴趣小组为了探究质量守恒定律,进行了如图所示的小实验.在一根用细铜丝吊着的长玻璃管两端,分别绕上40cm长的粗铜丝,并使玻璃棒保持水平,然后,用酒精灯给左边一端铜丝加热1~2分钟.停止加热后冷却,仔细观察发生的现象.
(1)冷却后,他们可以观察到的现象是:
①________________________________________________________________________;
②________________________________________________________________________.
(2)写出铜丝加热时所发生反应的化学方程式:________________________________.
如图是某同学学习了氢氧化钠的化学性质后绘制的知识络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,B能用于灭火,“﹣”表示相连两物质之间能相互反应.
(1)按物质分类,C属于 (填“氧化物”、“酸”、“碱”或“盐”).
(2)写出A、B的化学式:A ;B .
一种工业废水中含有大量的硫酸亚铁、少量硫酸铜和污泥(污泥不溶于水,且不参与化学反应)。某同学设计了一个既经济又合理的实验方案,制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜。方案流程如下:
【查阅资料】FeSO4·7H2O受热易分解。
回答下列问题:
(1)加入过量试剂a的目的是 。
(2)操作③中产生气体的化学方程式是 。
(3)下列说法正确的是 。
| A.溶液1中的溶质质量一定大于溶液2中的溶质质量 |
| B.溶液3中的质量分数大于或等于溶液2 |
| C.操作④中可以用蒸发溶剂结晶的方法 |
| D.操作③中所加物质一定要适量 |
含锌30%的黄铜用作弹壳的制造。现有一批使用过的、锈迹斑斑的弹壳,处理这些弹壳可以制得铜和硫酸锌,其主要过程如下图所示。
提示:弹壳上的锈主要为Cu2(OH) 2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、不参加反应。
(1)固体D为 。
(2)溶液A中加入E后发生反应的化学方程式为 。
工业废水中含有硫酸亚铁、硫酸铜和污泥。某同学设计了利用废水制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜的实验方案,流程如下:
已知:硫酸亚铁晶体受热易分解。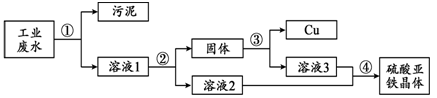
回答下列问题:
(1)步骤②中需加入的物质及目的是 。
(2)步骤③中发生反应的化学方程式为 。
(3)步骤④的操作是蒸发浓缩、降温结晶、 。
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到25g该石灰石样品中,得到如下部分数据和图象: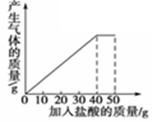
| 次数 |
第1次 |
第2次 |
第3次 |
| 加入盐酸的质量/g |
10 |
10 |
10 |
| 剩余固体的质量/g |
20 |
15 |
10 |
请计算:(1)石灰石样品中杂质的质量为 g。
(2)所加盐酸的溶质质量分数.
如图A~H是初中化学常见的物质,其中B为紫红色固体单质,A、D均为无色气体,且D可参与光合作用,E为一种常见的钠盐,F为一种碱,H为蓝色沉淀。它们的转化关系如下图(其中部分反应物、生成物、反应条件已略去,箭头所指为生成物),请回答下列问题:
(1)反应①发生的条件是 ;(2)C的化学式是 ;
(3)反应②的化学方程式 ;
(4)图中的转化至少能发生 个复分解反应。
已知A是固体碱式碳酸铜,其化学式是Cu2(OH)2CO3,它受热可分解为三种化合物,物质转化关系如图所示。其中C、F、H、I是无色气体,B通电时,在阴极产生I,在阳极产生H。根据推断回答下列问题:
(1)铜锈的主要成分是碱式碳酸铜。铜生锈与空气中氧气和水有关,还与空气中的____________(填化学式)有关。
(2)E物质的化学式是 。
(3)在①~⑥反应中属于化合反应的是 (填数字序号)。
(4)反应⑤的化学方程式 。
(6分)下图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物。胃液中含有适量的甲,可帮助消化。图中“—”表示两端的物质问能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物已略去。
(1)写出甲的化学式 。
(2)①若乙在常温下为液体,丙可用来改良酸性土壤,则乙的化学式为 ,丙的化学式为 。
②若乙在常温下为气体,且可由甲与大理石反应得到,则乙的化学式为 ,丙能与①中的丙发生复分解反应,其化学方程式为 (写出一个即可)。
③写出①中的乙和②中的乙发生化合反应的化学方程式为 。
试题篮
()