科学探究是认识和解决化学问题的重要实践活动。
近年来,自热食品种类繁多。只需将撕去塑料膜的发热包放入凉水中,就能享用美食,很受年轻人的追捧。实验小组同学买来一份自热食品进行以下探究。
【资料】Ⅰ.发热包中物质的主要成分是生石灰、碳酸钠、铝粒。
Ⅱ.铝能和 溶液反应生成偏铝酸钠( )和氢气,偏铝酸钠溶于水。
探究一:发热包的发热原理。
(1)小组同学取出发热包,撕去塑料膜,放入适量凉水中,可观察到的现象是 ,固体迅速膨胀,同时还可观察到发热包内固体变硬结块,其可能的原因是 (用化学方程式表示)。
(2)在使用发热包过程中,禁止明火的理由是 。
探究二:反应后混合物中部分成分的探究。
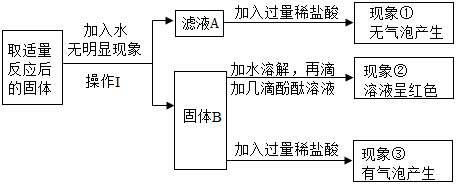
根据以上操作和实验现象回答下列问题。
(3)操作Ⅰ的名称是 。
(4)根据现象①得出:滤液A中一定不含的物质是 。根据现象②③分析得出:固体B中一定含有的物质是 。综合分析得出:现象③中产生的气体,其成分的组成可能为 。
(5)通过以上探究,同学们进行反思总结,你认为其中正确的是 。
| A. |
能与水混合放出热量的物质均可做发热包的发热材料 |
| B. |
发热包应密封防潮保存 |
| C. |
禁止用湿手接触发热包 |
| D. |
使用过程中应保持通风 |
随着人们生活水平的提高,汽车已经走进千家万户.
(1)在汽车电路中,经常用铜做导线,这是利用铜的延展性和 性.
(2)车体多用钢材制造,钢铁厂用赤铁矿为原料炼铁的原理是(用化学方程式表示) .
(3)为减少汽油燃烧产生的废气对环境的污染,我国开发推广使用一种车用乙醇汽油,其中含乙醇10%.请写出乙醇在空气中完全燃烧的化学方程式 .
根据表中信息,请回答下列问题。
| 测试类别 S化合价 |
氢化物 |
单质 |
① |
酸 |
盐 |
| +6 |
﹣ |
﹣ |
SO 3 |
H 2SO 4 |
Na 2SO 4CuSO 4FeSO 4(NH 4) 2SO 4 |
| ② |
﹣ |
﹣ |
SO 2 |
H 2SO 3 |
Na 2SO 3 |
| 0 |
﹣ |
S |
﹣ |
|
|
| ﹣2 |
H 2S |
﹣ |
﹣ |
H 2S |
Na 2S |
(1)填写表中内容:① ;② 。
(2)物质可以按照一定规律发生转化,请按要求各写出一个对应的化学方程式。
①置换反应 ;②复分解反应 。
(3)(NH 4) 2SO 4是农业上常用的铵态氮肥,在实验室检验其为铵态氮肥的实验操作是______(写出一种即可)
(4)2H 2S+SO 2═2S+2H 2O,反应前后硫元素化合价发生的变化是
(5)在实验室中,可用热的碱液除去试管内壁上附着的硫,请完成该反应的化学方程式: S+ NaOH═ Na 2SO 3+ + H 2O。
金属材料是重要的资源,在日常生活中已经得到越来越广泛的应用。
(1)将铝片和硬铝片相互刻画,铝片上留下明显的划痕,说明 。
(2)沙漠地区的铁制品锈蚀较慢,其原因是 。
(3)为了比较铁、铜、银三种金属的活动性顺序强弱,某同学设计了下列四种方案:
①将铁丝、银丝分别浸入硫酸铜溶液中;②将银丝分别浸入到硫酸亚铁、硫酸铜溶液中;
③将铜丝、银丝分别浸入到硫酸亚铁溶液中;④将铜丝分别浸入到硫酸亚铁、硝酸银溶液中其中可行的方案是 (填序号)。可行方案中发生的基本反应类型为 。
(4)工业上将赤铁矿石冶炼成铁是一个复杂的过程。炼铁高炉中发生的主要反应有:
①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳的反应;④焦炭充分燃烧,其中体现焦炭作用的反应是 (填序号)。
绵阳西北部山区石灰石资源非常丰富,大量用于生产水泥。用石灰石和砂岩黏土高温煅烧得到一种新型水泥熟料,主要反应为: 。
(1)上述反应涉及四类化合物中的哪几类? 。
(2) 的化学式可表示为 ,含 44.8%的水泥熟料中含 的质量分数为 。
(3)在实验室用如图所示方法粗略测定石灰石中 的质量分数,无需测定的数据是 (填序号)。
| A. |
取用石灰石样品的质量 |
| B. |
倒入的过量稀盐酸的质量 |
| C. |
盐酸接触样品前电子秤的读数 |
| D. |
反应停止后电子秤的读数 |
(4)用含 90%的石灰石1000t生产新型水泥熟料,理论上会排放 多少吨?(无计算过程不给分)

请你铵要求回答下列问题:
(1)阜新"宝地斯帕温泉"远近闻名。若要检验温泉水是硬水还是软水,可加入 检验。
(2)电解水的实验证明了水的组成。电解水的化学方程式为 。
(3)在做"细铁丝在盛有氧气的集气瓶中燃烧"的实验时,常常要在集气瓶里预先加少量的水,这样做的目的是 。
(4)为了设计实验证明二氧化碳能溶于水,某同学做了如图所示实验,该实验的现象是 。
(5)某纯净物X在空气中完全燃烧,反应的化学方程式为:X+2O 2  CO 2+2H 2O,则X的化学式为 。
CO 2+2H 2O,则X的化学式为 。
(6)氯化钠是食盐的主要成分,氯化钠的用途很多。例如,生活中的氯化钠是常用的调味品。此外,还可以利用氯化钠 等。

根据如图回答问题。
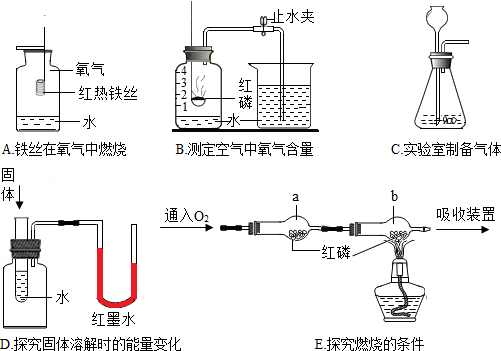
(1)A中集气瓶内水的作用是 。
(2)B中集气瓶内水位最终约在刻度 处。
(3)C中制备氧气的化学方程式是 。
(4)D中若加入的固体是NH 4NO 3,实验现象是 。
(5)E中探究可燃物燃烧的条件之一是 。
海洋中有丰富的水生生物和化学资源。海水晒盐能得到粗盐和苦卤,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题。
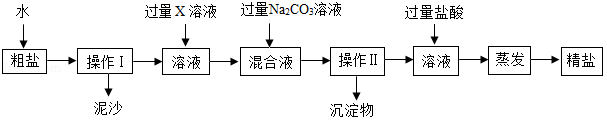
(1)蒸发过程中使用到玻璃棒,其作用是 。
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可依次加入过量的X和碳酸钠两种溶液。下列物质中,可作为X的物质有 。
A、KOH
B、Ba(OH) 2
C、Ca(OH) 2
D、NaOH
(3)操作Ⅱ后向所得滤液中加入适量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。
从古至今,铁及其化合物一直被人类广泛应用。
(一)铁及其化合物的应用

(1)明代科学著作《天工开物》中记载:
①“其器冶铁锥,其尖使极刚利”,“铁锥”为开挖盐井的工具。所取盐井水“入于釜中煎炼顷刻结盐”,“金”指生铁制作的铁锅。生铁属于 材料。上述描述中利用铁的 (选填序号)。
| A. |
a.导热性 |
| B. |
b.导电性 |
| C. |
c.硬度大 |
②“泥固塞其孔,然后使水转釉”是指高温下 将红砖中的
将红砖中的 转化为
转化为 而形成青砖。该转化的化学方程式为 。
而形成青砖。该转化的化学方程式为 。
(2)铁的化合物在现代更多领域发挥着重要作用。
①碳酸亚铁( )不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
)不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
②火星探测器发回的信息表明,火星上存在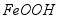 ,从而证明火星表面曾经存在过水,其理由为 。
,从而证明火星表面曾经存在过水,其理由为 。
③活性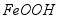 可除去石油开采过程中的有害气体
可除去石油开采过程中的有害气体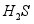 ,并获得
,并获得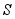 ,原理如下。
,原理如下。
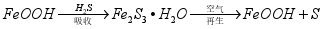
吸收中生成的另一种物质的化学式为 ,再生时发生反应的化学方程式为 。
(二) 的制备
的制备
用废铁屑(主要成分为 ,含少量
,含少量 和
和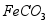 )制备
)制备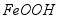 主要流程如下。
主要流程如下。
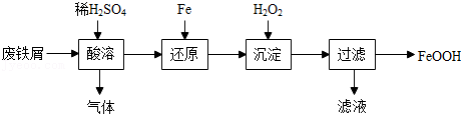
(1)酸溶时适当提高反应温度和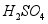 浓度,目的是 ,产生的气体为 。
浓度,目的是 ,产生的气体为 。
(2)还原发生的反应为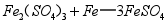 。
。
沉淀发生的反应为 。
。
沉淀时反应温度不宜太高,原因是 。
(3)沉淀时会有部分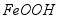 与
与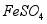 反应生成
反应生成 ,反应的化学方程式为 。
,反应的化学方程式为 。
(三)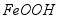 的含量测定
的含量测定
已知: 及铁的氧化物加热分解的温度如下。
及铁的氧化物加热分解的温度如下。

称取含 的
的 样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
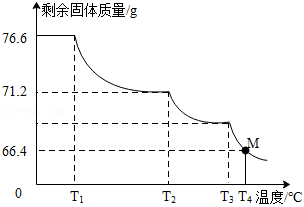
(1)样品中 的含量为 %(精确到0.1%)。
的含量为 %(精确到0.1%)。
(2)当加热到 时,M点固体的成分是 ,对应的质量比为 。
时,M点固体的成分是 ,对应的质量比为 。
如图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A图所示物质属于 (填物质分类),从微观角度说明理由是 ;
(3)画出比氧元素多一个周期少一个族的元素的原子结构示意图 .
我国古代科技璀璨夺目,金属的冶炼与使用在当时已处于世界先进水平。
(1)日常生活中,适合制作电缆的金属是______(填标号)。
| A. |
金 |
B. |
铜 |
C. |
汞 |
D. |
钨 |
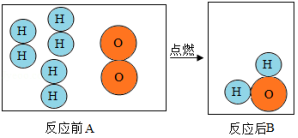
(2)明代《天工开物》描述了锡的冶炼方法,如图a。
①原料锡砂中的 和木炭反应得到锡和二氧化碳,化学方程式为______。
②炼锡时混入少许铅形成合金,产物更易熔化流出,原因是______。
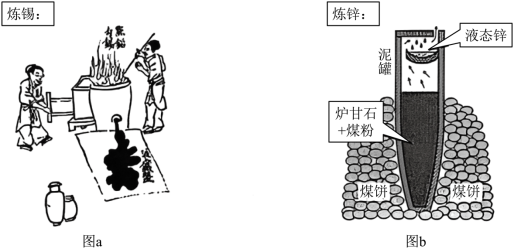
(3)图b为古代炼锌工艺原理示意图。炉甘石成分是 ,高温易分解生成 。
①泥罐外煤饼的主要作用是燃烧提供热量,泥罐内煤粉的主要作用是______。
②已知锌的沸点为 。泥罐下部温度可达 ,上部约为 ,该工艺从反应混合物中收集液态锌的方法属于______(填标号)。
| A. |
结晶 |
B. |
蒸发 |
C. |
蒸馏 |
D. |
升华 |
③必须冷却后才能取锌,是为了防止发生反应:______(写化学方程式)。
(4)湿法冶金利用置换反应。向 混合液中加入 粉,充分反应后过滤。若滤渣中有两种金属,则滤液中一定不含的金属阳离子是______。
已知H2与菱铁矿(主要成分 其他成分不参与反应)反应制成纳米铁粉。某小组进行探究并完成如下实验:
查阅资料:① 能与 反应生成 , 能使无水硫酸铜变蓝
② 与无水硫酸铜不反应
(1)某同学探究反应后气体成分,先将反应后气体通入无水硫酸铜,无水硫酸铜变蓝,证明气体中含有______,再通入足量的澄清石灰水,澄清石灰水变浑浊,反应方程式为______。
(2)对剩余气体成分进行以下猜想:
猜想一: 猜想二:______ 猜想三: 和
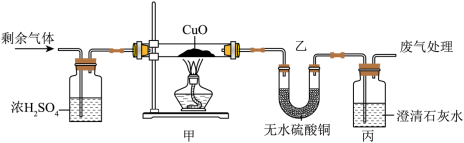
浓H2SO4的作用:______。
|
甲中现象:______。 乙中无水 变蓝 丙中变浑浊 |
猜想______正确 |
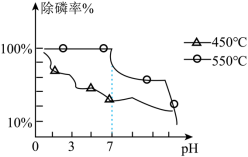
(3)热处理后的纳米铁粉能够除去地下水中的磷元素,如图所示 或者 热处理纳米铁粉的除零率以及 值如图所示,分析______ 时以及______(酸性或碱性)处理效果更好。
工业上用 溶液蚀刻铜箔制造印刷电路板,反应为 ,蚀刻废液又可再处理,实现资源回收和循环利用,其流程转化关系如图。
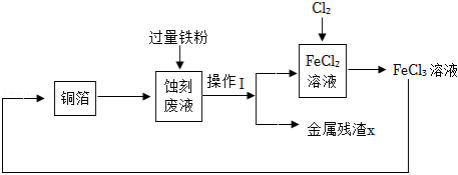
请回答相关问题。
(1)“蚀刻废液”的全部溶质有 和少量 。操作Ⅰ的名称是 。
(2)参照上述流程,画出由“金属残渣X”分离回收 和 溶液的简单流程图。
(3)上述流程中,能使三价铁转化为二价铁的物质有 。
(4)蚀刻掉128g铜,消耗 的质量为 g,理论上至少需要20% 溶液的质量为 g。(不需要写出计算过程)
氢是实现碳中和的能源载体。
(1)煤制氢的原理可表示为 。
① 中肯定含有的元素是 。
②煤制氢的不足是 (写出一点)。
(2)甲烷制氢包括重整、转化和分离等过程。甲烷制氢过程中产生的 和 的混合气分离得到 的过程如下:
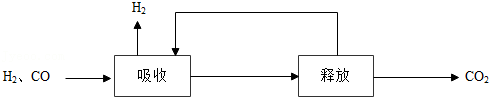
①海水作为吸收剂时,下列措施有利于海水吸收二氧化碳的是 (填序号)。
a.升高海水的温度
b.加快混合气的流速
c.增大气体的压强
②利用 溶液吸收 ,将其转化为 , 在加热条件下即可分解生成 。比较 和 分解反应的不同,可推知 的稳定性 (填“>”或“<”) 的稳定性。
③使用氢氧化钠溶液吸收二氧化碳并分离出氢气。补充完整氢氧化钠循环使用的方案。
步骤1:将氢气和二氧化碳的混合气通入足量的氢氧化钠溶液中。
步骤2:向步骤1所得的溶液中 。
步骤3:过滤,得滤渣和氢氧化钠溶液。
(3)某种利用太阳能制氢的过程如图1所示。
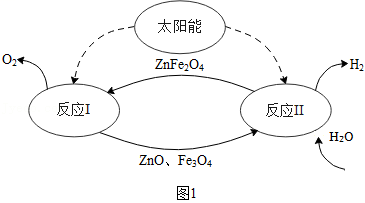
①反应I的基本类型为 。
②写出反应Ⅱ的化学方程式: 。
(4)我国2030~2050年各种能源使用预期情况如图2所示。
①图2所涉及的能源中,属于不可再生能源的是 。
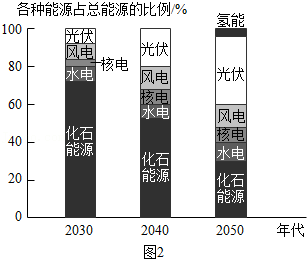
②2030~2050年,预期我国能源结构的变化趋势是 。
碱式碳酸锌[Zn x(OH) y(CO 3) z]是制备功能材料ZnO的原料,其化学反应表达式为:Zn x(OH) y(CO 3) z  ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
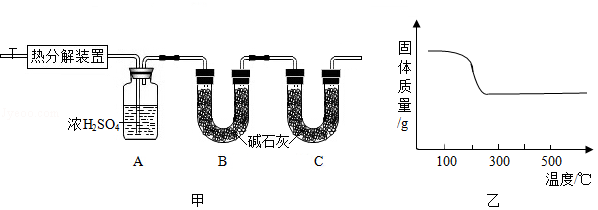
(1)图甲中装置B的作用是 。
(2)查阅资料发现,在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到 ℃(选填"200"、"300"或"400")。
(3)部分实验步骤为:"……加热前先通入N 2排尽装置内的空气,关闭通入N 2的活塞,……控制一定温度下加热……"。实验过程中可根据 现象判断碱式碳酸锌样品已反应完全。
(4)小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x:y:z的最简整数比为 。
试题篮
()