(1)如图1为实验室制取并收集气体的装置图,请回答下列问题。
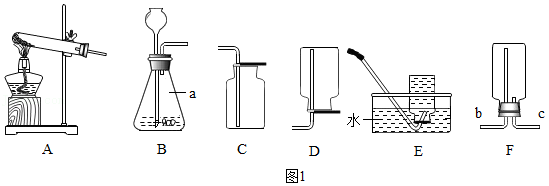
①仪器a的名称是 。
②若用A装置制取氧气,写出对应的化学方程式 。
③若需收集一瓶较纯净的氧气,应选用的装置是 (填装置序号)。
④若用C装置收集一瓶二氧化碳气体,其验满的方法是 。
⑤二氧化硫是一种有刺激性气味的有毒气体,比空气的密度大,易溶于水且与水反应。若用F装置收集二氧化硫气体,则气体应从 (填“b”或“c”)端导入。
(2)电解饱和食盐水可以制得氢氧化钠、氯气(Cl2)和氢气,并进而生产具有消毒、漂白作用的漂白液。
①粗盐中的难溶性杂质可通过溶解、 操作除去,以免破坏电解装置。
②写出电解饱和食盐水的化学方程式 。
③某同学想知道某一瓶放置一段时间的漂白液是否变质,设计了下列探究实验。
【查阅资料】
Ⅰ.制取漂白液(有效成分为NaClO)的原理:Cl2+2NaOH═NaCl+NaClO+H2O;
Ⅱ.在空气中NaClO易发生反应:2NaClO+H2O+CO2═Na2CO3+2HClO,HClO能使有色布条褪色,且HClO含量越高,漂白效果越好;HClO易分解,分解后丧失漂白作用;
Ⅲ.Ca(ClO)2易溶于水。
【提出问题】放置一段时间的漂白液是否变质?
【提出猜想】
猜想1:未变质,溶液中主要成分为NaCl、NaClO
猜想2:部分变质,溶液中主要成分为NaCl、NaClO、Na2CO3
猜想3:全部变质,溶液中主要成分为NaCl、Na2CO3
【实验探究】
|
实验操作 |
实验现象 |
实验结论 |
|
ⅰ取适量该溶液于烧杯中,放入有色布条 |
|
猜想3不成立 |
|
ⅱ另取适量该溶液于试管中,滴入适量氯化钙溶液 |
产生白色沉淀 |
猜想 成立 |
写出实验操作ii中产生白色沉淀的化学方程式 。
【拓展应用】由【查阅资料】和图2可知,需控制pH约为 时(填整数),漂白液具有最佳漂白能力。

实验桌上有一瓶敞口放置的氢氧化钠溶液,同学们对其是否变质进行实验探究。
【提出问题】敞口放置的氢氧化钠溶液是否变质呢?
【猜想与假设】
猜想Ⅰ:没有变质。
猜想Ⅱ: 。
猜想Ⅲ:部分变质。
【实验探究】
同学们分别设计了不同方案进行探究,请你协助完成相关内容。
(1)小军设计的实验方案
|
实验步骤 |
实验现象 |
结论 |
|
①取一定量的NaOH溶液于试管中,滴加无色酚酞溶液 |
溶液变成红色 |
猜想Ⅲ成立 |
|
②向①的试管中滴加过量的稀盐酸 |
有 产生 |
(2)小慧设计的实验方案
|
实验步骤 |
实验现象 |
结论 |
|
①取一定量的NaOH溶液于试管中,滴加过量的BaCl2溶液 |
有白色沉淀产生 |
猜想Ⅲ成立 |
|
②实验①结束后进行过滤,向得到的滤液中滴加 。 |
溶液变成蓝色 |
【反思与评价】
(3)同学们讨论认为,小军的实验结论不严密,理由是 。
【拓展实验】
(4)小慧实验②中所加的试剂替换为下列 操作,也可以实现相同的目的。
a.测溶液的pH
b.滴加MgSO4溶液
c.通入CO2
d.滴加稀盐酸
(5)若要除去NaOH溶液中混有的Na2CO3,涉及反应的化学方程式为 。
达州市九年级学生在5月份进行了实验操作考试,某实验室的老师准备实验药品时发现一瓶氢氧化钠固体未盖瓶塞。对于该固体是否变质,老师让三位同学通过实验来探究:
【提出问题】氢氧化钠是否变质?变质程度如何?
【猜想与假设】
猜想Ⅰ:没有变质,全部是NaOH;
猜想Ⅱ:部分变质,固体是NaOH和Na2CO3;
猜想Ⅲ:全部变质,全部是Na2CO3。
氢氧化钠变质的原因 (用化学方程式表示)。
【设计并进行实验】取一定量的固体溶于水配制成溶液,分成三份,三位同学按照自己的方案进行以下实验:
|
实验操作 |
实验现象 |
实验结论 |
|
|
小李 |
向第一份溶液中加入无色酚酞试液 |
溶液变红 |
猜想Ⅰ成立 |
|
小王 |
向第二份溶液中滴加几滴稀盐酸 |
无明显现象 |
猜想Ⅰ成立 |
|
小陈 |
向第三份溶液中加入CaCl2溶液 |
|
猜想Ⅲ成立 |
【分析讨论】
①小王和小陈认为碳酸钠溶液也能使无色酚酞试液变红,因此小李的结论不正确。
②经过讨论他们认为通过小王的实验不能得出样品中一定不含Na2CO3,原因是 。
【得出结论】综合三位同学的实验操作和现象可以得出猜想 成立。
实验结束后大家将废液倒入同一个废液缸内观察到废液呈红色,且有白色沉淀。为了不污染环境,他们向废液缸里加入一定量的稀盐酸后得到无色澄清溶液,所得溶液中溶质(酚酞除外)种类最多时,溶液中所含有的离子有 (填离子符号)。
【反思与拓展】
(1)大家一致认为实验室的NaOH必须密封保存。
(2)已知:①Na2CO3+CO2+H2O═2NaHCO3
②NaHCO3+NaOH═Na2CO3+H2O
如果向NaOH溶液中通入一定量的CO2气体,反应后所得溶液中溶质的组成有 种情况(不考虑CO2和H2CO3作溶质)。
兴趣小组的同学为探究在空气中久置的某氢氧化钠样品是否变质,设计了如图所示的A、B、C、D四组探究实验。
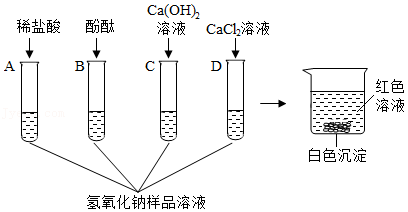
【查阅资料】氯化钙、氯化钡溶液都呈中性。
【实验探究】取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示。
【分析与结论】(1)上述四组实验中不能达到实验目的的是 (填字母序号)。
(2)实验A中,观察到 的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是 。
【继续探究】实验结束后,同学们将四支试管中反应后的混合物全部倒入一个洁净的大烧杯中(如图),充分搅拌、静置,观察到烧杯内上层清液呈红色,下层有白色沉淀。
【提出问题】上层清液呈红色,说明溶液呈碱性。上层清液中呈碱性的物质是什么?
【猜想与假设】上层清液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种或两种。
【设计实验】取少量烧杯中的上层清液于试管中,加入过量的氯化钡溶液,观察现象。
【现象与结论】
|
预测现象 |
结论 |
|
①若有白色沉淀生成,溶液呈红色 |
上层清液中呈碱性的物质是
|
|
②若无沉淀生成,溶液呈红色 |
上层清液中呈碱性的物质是氢氧化钙。 |
【实验反思】同学们认为上述预测现象②所得结论不严密,原因是 。
小杨在实验室做酸碱盐的性质实验时发现,一瓶标注氢氧化钠溶液的试剂瓶是敞口放置的。为了检验这瓶氢氧化钠溶液是否变质,小杨与同组的另两位同学共同探究:
(1)他们依据所学的化学知识,对这瓶溶液的成分作了如下猜想:
猜想一:可能是NaOH溶液;
猜想二:可能是Na2CO3溶液,作出此猜想的理由是 。
猜想三:可能是 。
(2)查阅资料得知:Na2CO3溶液能使酚酞溶液变红,CaCl2溶液、BaCl2溶液呈中性。为了验证溶液中是否含有Na2CO3,三位同学各取少量待测试剂于小试管中,分别滴加①酚酞溶液、②稀盐酸、③澄清石灰水,并依据产生的实验现象得出相同结论:溶液中一定含有Na2CO3.你认为他们所选试剂正确的是 (填字母代号)。
A.①②③
B.①②
C.②③
D.①③
(3)为了验证“猜想二”正确还是“猜想三”正确,他们又做了以下实验:①取少量待测试剂于试管中,滴加足量 溶液,溶液变浑浊;②过滤;③在滤液中滴加酚酞溶液,变红,所以 (填“猜想二”或“猜想三”)正确。如果在已经变红的溶液中逐滴加入稀盐酸,观察到的实验现象是 。
化学老师交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质。该小组的同学进行了如下实验探究:
[提出问题]
猜想Ⅰ:没变质,全部是 ;
猜想Ⅱ:部分变质,既含有NaOH又含有Na2CO3;
猜想Ⅲ:完全变质,全部是Na2CO3。
[查阅资料]
i.已知信息:BaCl2+Na2CO3═2NaCl+BaCO3↓
ⅱ.部分盐溶液在常温下的pH如下:
|
稀溶液 |
NaCl |
Na2CO3 |
BaCl2 |
|
pH |
等于7 |
大于7 |
等于7 |
[设计方案并进行实验]
请你与他们一起共同完成,并回答所给问题:
|
实验步骤 |
实验现象 |
实验结论 |
|
①称取上述氢氧化钠固体样品10.00g溶于50mL水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应,静置 |
|
说明久置固体中,一定含有Na2CO3 |
|
②用 蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与 比较,测出pH |
pH=11 |
说明久置固体中,还一定含有 (填化学式) |
滴加过量BaCl2溶液的目的是 。
[实验结论]通过实验,说明上述猜想中 (填“猜想Ⅰ”、“猜想Ⅱ”或“猜想Ⅲ”)是正确的。
[拓展]该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为9.85g,则原试剂中NaOH的质量分数为 (假定试剂中无其他杂质,忽略实验损耗)。
[反思]久置氢氧化钠变质的原因是 (用化学方程式表示)。
[提升]能否通过取适量试剂溶于水,然后滴加酚酞的方法作出判断: (填“能”或“不能”),理由是 。
某兴趣小组发现,上周做实验用的氢氧化钠固体忘记了盖瓶盖,他们欲对该固体的变质情况进行探究。
[提出问题]该瓶氢氧化钠固体是否变质,变质情况如何?
[查阅资料]①碳酸钠溶液的pH最大约为10.6,饱和的碳酸氢钠溶液pH约为8.0,氯化钙溶液呈中性。
②NaOH、Na 2CO 3分别在水和酒精中的溶解度如下表所示:
|
物质种类 |
NaOH |
Na 2CO 3 |
|||
|
温度 |
20℃ |
40℃ |
20℃ |
40℃ |
|
|
溶剂 |
水 |
109g |
129g |
21.8g |
49g |
|
酒精 |
17.3g |
40g |
不溶 |
不溶 |
[作出猜想]猜想Ⅰ:固体未变质;猜想Ⅱ:固体部分变质;猜想Ⅲ:固体全部变质。
[实验探究](1)兴趣小组同学取少量样品于烧杯中,加适量水溶解,测得溶液的pH约为12.由此他们得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是 。
(2)组内其他同学取步骤(1)烧杯中少量溶液于试管中,加入过量的 溶液,振荡,有白色沉淀生成;不再产生沉淀时,取上层清液于另一支试管中,滴加 ,溶液变红。
[实验结论]通过实验,兴趣小组证明猜想 正确。
[反思评价]根据查阅资料,有同学提出可以通过氢氧化钠和碳酸钠在酒精中溶解度不同来验证猜想Ⅲ正确。请你帮助他设计实验方案: 。
[实验拓展]实验室使用pH传感器来测定Na 2CO 3和NaHCO 3混合物中NaHCO 3的含量。称取一定量样品,溶于水配成250.0mL溶液。将pH=1的稀盐酸逐滴加入体积为25.0mL的该溶液中,所得曲线如图所示:
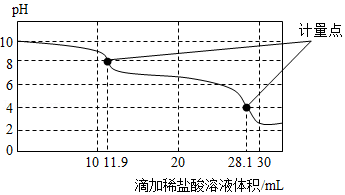
a.上一个计量点前发生反应的化学方程式为 。
b.下一个计量点时溶液中大量存在的阴离子是 。
某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们进行了以下探究:
[提出问题]
氢氧化钠溶液是否变质?变质程度如何?
[做出猜想]
猜想一:氢氧化钠溶液未变质
猜想二:氢氧化钠溶液完全变质
猜想三:
[设计实验]请完成实验报告
|
实验步骤 |
实验现象 |
实验结论 |
|
①取少量溶液于试管中,加入 ,充分反应。 |
|
猜想二成立 |
|
②将步骤①试管中的物质过滤,向滤液中加入 。 |
无明显现象 |
[反思拓展]
(1)氢氧化钠溶液变质的原因 (用化学方程式表示),氢氧化钠溶液应 保存。
(2)分别取两份完全变质的氢氧化钠溶液样品于试管中,向其中一份加入盐酸有气泡产生,另一份加入氢氧化钙溶液有白色沉淀产生,然后将两支试管中所有物质一起倒入废液缸中,得到无色澄清溶液,所得溶液中溶质一定有 。
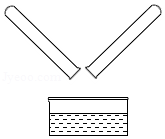
敞口放置于空气中的氢氧化钠溶液能够发生下列变化而变质:
NaOH溶液 Na2CO3溶液 NaHCO3溶液
上述反应①的化学方程式为 ,NaHCO3俗称 。
某校化学学习小组师生对一瓶氢氧化钠溶液的变质情况进行了如下探究:
[提出问题]NaOH是否变质?
[做出猜想]
猜想1:NaOH全部变质。
猜想2: 。
[制定计划]老师探究是否产生了NaHCO3,学生在老师探究的基础上进一步探究。
[进行试验]
|
试验操作 |
试验现象 |
试验分析 |
|
|
老师试验 |
略 |
略 |
没有产生NaHCO3 |
|
学生试验 |
a.取一定量的待测液于试管中,加入足量CaCl2溶液 |
产生白色沉淀 |
反应的化学方程式为 |
|
b.充分反应后静置,取上层清液加入无色酚酞溶液 |
溶液变红 |
原待测液中含有 |
[表达交流]有同学认为上述实验a中的CaCl2溶液可改为澄清石灰水,你是否同意这种看法? (填“同意”或“不同意”)。
[实验结论]上述猜想2成立。
[反思评价]在实验室中,氢氧化钠应密封保存。
某化学兴趣小组在实验室取用NaOH溶液时,发现瓶口有白色粉末状物质,该小组质疑该NaOH溶液可能已变质,于是进行了如下探究:
[猜想与假设]
|
猜想 |
Ⅰ.没有变质 |
Ⅱ.部分变质 |
Ⅲ.完全变质 |
|
溶液中溶质 |
NaOH |
NaOH、Na2CO3 |
Na2CO3 |
[探究过程]
(1)取一定量的该NaOH溶液,加入足量的 ,有气泡产生,说明猜想Ⅰ不成立。产生气泡的化学方程式为 。
(2)重新取一定量的该NaOH溶液,加入足量的CaCl2溶液,观察到的现象为 。接下来的实验操作及观察到的现象是: ,则说明猜想Ⅱ成立。若将CaCl2溶液换为Ca(OH)2溶液是否可行,判断并简述理由: 。
[结论与反思]
NaOH易与空气中的CO2反应而变质,故应注意密闭保存。
小娟同学发现,上个月做化学实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,小娟和同学们进行了如下探究活动。
[提出问题]该瓶氢氧化钠溶液是否变质及变质的程度?
[查阅资料]氯化钡溶液呈中性。
[猜 想]①该溶液没有变质;
②该溶液全部变质;
③该溶液部分变质。
[进行实验]小娟和同学们按如下方案进行了实验。

[问题讨论]
(1)操作Ⅰ的名称是 。
(2)写出产生白色沉淀的化学反应方程式 。由此现象可得出:猜想 ① (填序号)错误。
(3)结合操作Ⅰ和Ⅱ,若“现象X”是溶液不变色,则猜想 ② (填序号)正确;若“现象X”是 ,则猜想③正确。
[拓展应用]
(1)小娟和同学们通过以上实验探究得出,实验室保存氢氧化钠溶液的方法是 。
(2)如果氢氧化钠溶液中混有少量碳酸钠杂质,常加入适量 (填“BaCl2”或“Ba(OH)2”)除去。
中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4•7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
(1)请写出铁与稀硫酸反应的方程式 。
(2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4•7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
[查阅资料]
①FeSO4易被空气中的氧气氧化成Fe2(SO4)3而变质。
②Fe2+在溶液中呈浅绿色,Fe3+在溶液中呈黄色。
③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
[猜想与假设]猜想1:该硫酸亚铁溶液没有变质。
猜想Ⅱ:该硫酸亚铁溶液已经变质。
[设计实验并验证]
|
实验操作步骤 |
实验现象 |
实验结论 |
|
取少量样品于试管中,加入2﹣3滴 溶液 |
试管中溶液变成血红色 |
|
[实验拓展1]下列各组物质在溶液中能大量共存,且形成无色溶液的是 。
A.CuSO4、NH4Cl、Ba(OH)2
B.FeSO4、Na2SO4、KCl
C.FeCl3、NaOH、HCl
D.NaCl、MgSO4、KNO3
[实验拓展2]该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量铁粉,写出其中的化学方程式 。
宏宏同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,宏宏邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(1)【提出问题1】
该溶液是否变质?
【实验探究1】
|
实验步骤 |
实验现象 |
解释与结论 |
|
取少量该溶液放于试管中,滴加足量稀盐酸 |
有 产生 |
说明该溶液已变质。变质的原因是 (请用化学方程式表示)。 |
(2)【提出问题2】
该溶液变质程度怎样?
【提出猜想】
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有 。
【查阅资料】
氯化钡溶液呈中性。
【实验探究2】
|
实验步骤 |
实验现象 |
结论 |
|
先取少量该溶液放于试管中,加入过量氯化钡溶液 |
有 生成 |
猜想 成立 |
|
静置,取上层清液于另一支试管中,加入2﹣3滴酚酞溶液 |
上层清液变红 |
(3)【提出问题3】
怎样提纯该样品得到纯净的氢氧化钠固体。
【实验探究3】
为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。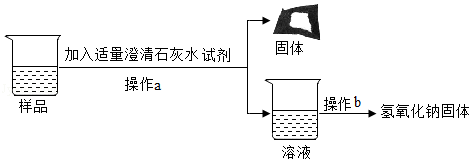
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为 。
②根据实验流程可知,最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)【反思交流】
在【实验探究2】中加入过量的氯化钡溶液的目的是什么? 。
甲、乙、丙三位同学对一瓶实验室久置的 NaOH 溶液变质程度进行实验探究。
(1)甲同学取少量该溶液于试管中,滴加 2~3 滴酚酞溶液,观察到 ,他认为该溶液未变质。
(2)乙同学查阅资料获知,Na2CO3溶液遇指示剂变色与NaOH 溶液相同,认为甲同学的检验方法不正确。乙同学取少量该溶液于试管中,加入足量稀盐酸,观察到 ,他认为已完全变质。写出此现象的化学方程式 。
(3)丙同学认为乙同学的实验结论不严谨,他的猜想是 。 他用如下实验方案来证明自己的猜想:
①取少量该溶液于试管中,先加入足量的BaCl2溶液,产生白色沉淀,说明原溶液中存在 。(填化学式)
②静置后取上层清液于另一支试管中,加入 2~3滴酚酞溶液,观察到溶液变红色,说明原溶液中存在 。(填化学式)
化学实验小组的同学在实验室里发现桌上有瓶敞口放置已久的NaOH溶液,他们对溶质的成分产生了探究的欲望。
[查阅资料]Ca 2+和OH ﹣在水溶液中不能大量共存
[提出问题]这瓶NaOH溶液一定变质了,其变质程度如何呢?
[提出猜想]猜想一:NaOH溶液部分变质 猜想二:NaOH溶液完全变质
[实验探究]
(1)氢氧化钠溶液变质的原因为 (用化学方程式表示)。
(2)小华设计了如下实验进行探究,请根据表中内容填写:
|
实验步骤 |
现象 |
结论 |
|
|
步骤一 |
取少量NaOH溶液样品于试管中,向其中滴加过量的CaCl 2溶液 |
产生白色沉淀 |
猜想 成立 |
|
步骤二 |
过滤,向滤液中滴加酚酞溶液。 |
酚酞溶液变红 |
|
如果步骤一中白色沉淀由两种物质组成,则两种物质是 (填化学式);步骤二中根据酚酞溶液变红这一现象证明样品中含有 (填字母)。
A.CaCl 2B.Na 2CO 3C.NaOH D.Na 2CO 3和NaOH
[实验反思]
(1)下列物质①BaCl 2溶液、②Ca(NO 3) 2溶液,③Ca(OH) 2溶液、④Ba(OH) 2溶液,不能替代步骤一中CaCl 2溶液的是 (填序号)。
(2)步骤二中用另外一种试剂代替酚酞溶液也能得出同样的结论,发生反应的化学方程式为 。
试题篮
()