下列各组离子能在pH=12的溶液中共存的一组是( )
A.H+、K+、CO32﹣B.Ba2+、OH﹣、SO42﹣
C.Na+、Cl﹣、NO3﹣D.Mg2+、NH4+、SO42﹣
亚硝酸钠是一种工业用盐,外形与食盐相似,有咸味,有毒。人若误食会引起中毒,甚至致人死亡。已知亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。
(1)鉴别亚硝酸钠和氯化钠,你会选用什么试剂? ,如何操作? 。
(2)某实验小组成员李雷从人教版普通高中教科书《化学1》中得知碳酸钠的水溶液也呈碱性。该组成员就碳酸钠溶液呈碱性的原因进行了如下初探:
【查阅资料】
Ⅰ.大多数可溶性的盐溶解在水中会完全解离,产生自由移动的阴阳离子。如Na2CO3、KCl等。
Ⅱ.难溶性物质在水中解离出的阴阳离子极少,忽略不计。如CaCO3、BaCO3等。
Ⅲ.CaCl2的水溶液呈中性。
【猜想与假设】猜想Ⅰ:碱性是由溶液中解离出的Na+引起的;
猜想Ⅱ:碱性是由溶液中解离出的CO32﹣引起的;
………………
【实验设计】
实验步骤 |
实验现象 |
向1支洁净的小试管中加入3mL饱和碳酸钠溶液,滴入3滴酚酞溶液,振荡,再逐滴滴入氯化钙溶液至过量 |
试管中溶液颜色先由无色变为红色,然后逐渐变浅至消失 |
写出上述实验步骤中滴入CaCl2溶液后红色变浅至消失的原因 (用化学方程式解释)。
【实验结论】 。
【实验拓展】据此判断下列物质的水溶液可能使酚酞溶液变红的是 (填字母)。
A.CaCl2
B.CaCO3
C.H2SO4
D.K2CO3
【总结反思】该组同学善于发现问题,并设计实验探究问题。通过本次探究,他们认识到,并不是碱溶液才显碱性,盐溶液也可能呈碱性。他们还会进一步查阅资料探寻碳酸钠溶液呈碱性的本质原因和基本规律。
化肥对提高农作物的产量有重要作用,下列物质可用作氮肥的是( )
A.CaSO4B.K2SO4C.NH4NO3D.Ca3(PO4)2
以下四个图象与对应操作描述不相符的是( )
A. 水通直流电
水通直流电
B. 加热分解高锰酸钾
加热分解高锰酸钾
C. 向20mL pH=13的NaOH溶液中逐滴滴入pH=1的盐酸
向20mL pH=13的NaOH溶液中逐滴滴入pH=1的盐酸
D.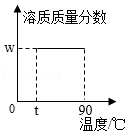 t℃时取溶质质量分数为w的KNO3饱和溶液20g,升高温度至90℃
t℃时取溶质质量分数为w的KNO3饱和溶液20g,升高温度至90℃
饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A.氢氧化铝B.氯化钠C.碳酸镁D.碳酸氢钠
根据如图实验,说法正确的是( )
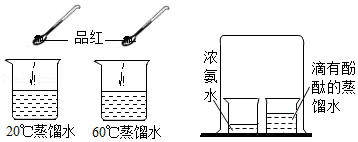
A.品红的扩散速度相同
B.浓氨水变红
C.氨水显碱性,pH大于7
D.分子运动速率与温度无关
某同学向盛有Ca(OH)2溶液的烧杯中加入K2CO3溶液到一定量时停止了实验,烧杯中产生了白色沉淀,发生的化学反应方程式为 。为了探究反应后液体的成分,用两支试管各取少量过滤后的滤液,继续做以下实验:
(1)向第一支试管的滤液中加入稀盐酸,有气泡产生,则滤液中的溶质是 (填化学式)。
(2)向第二支试管的滤液中通入足量的CO2气体后,再蒸干滤液,得到白色固体,该物质在农业生产中的用途: (写一点即可)。
根据家庭小实验,回答下列问题。
(1)厨房中白醋和料酒的标签已模糊不清,不通过品尝,可以用 的方法就能快速区分开来。
(2)如图所示,玻璃杯底固定一支燃着的蜡烛,在蜡烛周围放一些物质,再沿玻璃杯内壁倒入白醋可以使燃着的蜡烛熄灭(白醋未淹没蜡烛),则这种物质可能是 (选填序号)。
①碎鸡蛋壳 ②纯碱 ③白糖 ④食盐

下列图示与相应的文字描述完全符合的是( )
A.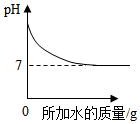 加水稀释NaOH溶液
加水稀释NaOH溶液
B. 加热分解KMnO4固体
加热分解KMnO4固体
C.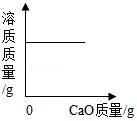 向饱和石灰水中加入CaO
向饱和石灰水中加入CaO
D.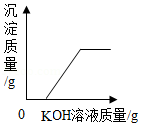 向稀硫酸和硫酸铜的混合溶液中加入KOH溶液
向稀硫酸和硫酸铜的混合溶液中加入KOH溶液
下列各组物质的溶液,必须另加试剂才能鉴别出来的一组是( )
A.K2CO3、NaCl、BaCl2B.HCl、CaCl2、Na2CO3
C.NaOH、KNO3、CuSO4D.NH4Cl、Ba(OH)2、Na2SO4
根据物质的特征反应进行物质的鉴别是一种常用的科学方法。现有两瓶失去标签的氯化钠溶液和碳酸钠溶液,分别标为A和B.鉴别试剂有无色酚酞试液、稀盐酸和硝酸银溶液。某同学选用无色酚酞试液进行鉴别,发现A溶液不变色,由此可确定A是 溶液。 他还可以选择上述试剂中的 进行鉴别。
学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )

A.①B.②C.③D.④
小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如图:
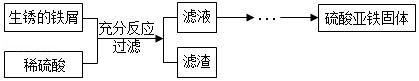
资料:①Fe2(SO4)3+Fe═3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。
试题篮
()