硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: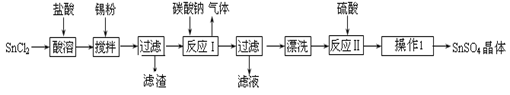
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡,Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是 。
(10分)皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。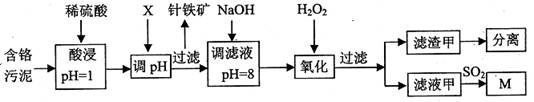
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Al3+ |
Cu2+ |
Mg2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
3.7 |
4.7 |
6.7 |
--- |
| 沉淀完全时的pH |
3.2 |
8.0 |
6.7 |
9.3 |
9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是 (任写一条)。
(2)调节pH所用X可以选用 。
A.NaOH B.Na2C03 C.H2S04 D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为 。
(4)调滤液至pH=8,则滤液中 将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)= 。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: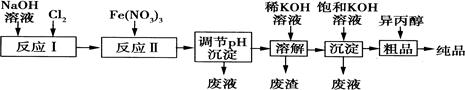
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
[化拳——化学与技术](15分)
粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为 等。 一种利用粉煤灰制取氧化铝的工艺流程如下:
等。 一种利用粉煤灰制取氧化铝的工艺流程如下: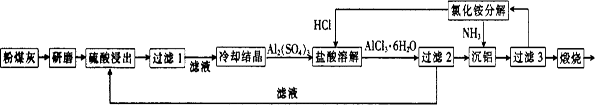
(1)粉煤灰研磨的目的是 。
(2)第1次过滤时滤渣的主要成分有 (填化学式,下同)和 ,第3次过滤时滤渣的成分是
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例)。
相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例)。

(4)流程中循环使用的物质有——和——。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13·6H20,该过程能够发生的原因是
(6)用粉煤灰制取含铝化合物的主要意义是
(14分)某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。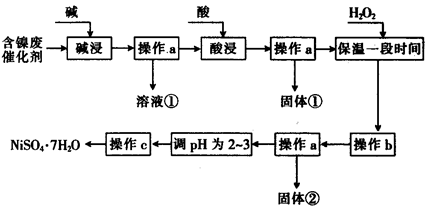
部分阳离子以氢氧化物形式沉淀时的pH如下: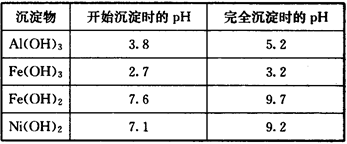
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)产品晶体中有时会混有少量绿矾(FeS04·7H20),其原因可能是 (写出一点即可)。
(6)NiS04·7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
选考【化学---选修2:化学与技术】
MgSO4·7H2O在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/ ℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)沉淀C的化学式是
(2)过滤Ⅲ需趁热过滤的理由是
(3)操作Ⅰ和操作Ⅱ的名称分别为 、
(4)滤液I中加入硼镁泥,调节溶液的pH=5~6,可除去滤液Ⅰ中 (填离子符号);加入NaClO溶液加热煮沸,可将Fe2+氧化成Fe3+的同时,还会将溶液中的Mn2+氧化成MnO2,写出Mn2+被氧化成MnO2的离子反应方程式为
(5)硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣。将硼镁矿(Mg2B2O5·H2O)煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应,试写出反应方程式
近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 。用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应III中发生反应的化学方程式为CaSO4+4C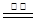 CaS+4CO↑ CaS+4CO↑ |
| C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应V中的副产物氯化铵可用作氮肥 |
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下: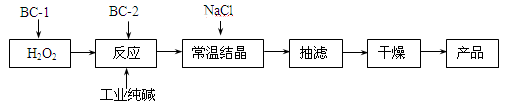
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是 。
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+ 杂质生成稳定的配合物的目的是 。
(3)洗涤抽滤产品,应选用合适的洗涤试剂是 (填写序号)。
| A.饱和氯化钠溶液 | B.水 | C.异丙醇 | D.碳酸钠饱和溶液 |
(4)工业上常以活性氧的质量分数[ω(活性氧)=16 n(H2O2) / m(样品) ×100﹪]来衡量过碳酸钠产品的优劣,ω≥13﹪为优等品。现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol/LNa2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程)。
硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:
(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是 。
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。
(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是:x= ,pH控制在 范围。
②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:
已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
②BaCO3的相对分子质量是197; BaCl2.2H2O的相对分子质量是244。
(1)SiCl4发生水解反应的化学方程式 。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式 。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2;② ;
(4)生成滤渣A的离子方程式: ;
(5)BaCl2滤液经 、 、过滤、洗涤,再经真空干燥后得到BaCl2.2H2O。
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_ 吨。
(14分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是 (用电极反应式解释)溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:
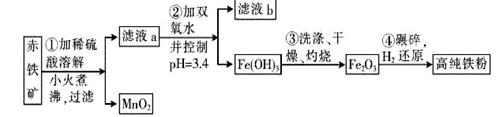
已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
(3)步骤②中加双氧水的目的是 ,pH控制在3. 4的作用是 。已知25°C时,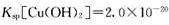 ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净?
(5)制备氮化铁磁粉的反应: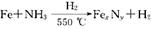 (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
【化学——选修2化学与技术】
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
| A.升高温度 | B.通入过量的空气 |
| C.将原料粉碎 | D.增加纯碱的用量 |
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成分是
| A.NaOH | B.NaClO | C.KMnO4 | D.Na2O2 |
实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。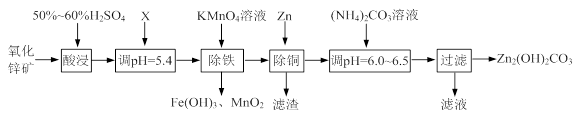
(1)“酸浸”时保持H2SO4过量的目的是 。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式: 。
②流程中调节pH=5.4所加试剂X为 (填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由 。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。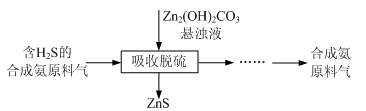
皮革工业污泥中含较多的Cr,工业采用以下工艺制得M[Cr(OH)(H2O)5SO4]。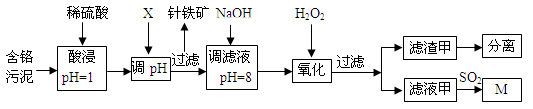
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Al3+ |
Cu2+ |
Mg2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
3.7 |
4.7 |
9.3 |
--- |
| 沉淀完全时的pH |
3.2 |
8.0 |
6.7 |
11.1 |
9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________________(任写一条)。
(2)调节pH所用X可以选用 。
A.NaOH B.Na2CO3 C.H2SO4 D.HNO3
(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式 。针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(4)调滤液至pH=8,Al3+、Cu2+、Mg2+中的_________将转化为沉淀。
(5)若滤液甲的pH=a,则溶液中c (Cu2+)= 。(25℃时的Ksp[ Cu(OH)2]=2.2×10-20)
试题篮
()