选做【化学—化学与技术】工业上一种制备氯化铁及高铁酸钾的工艺流程如下: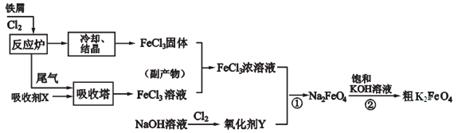
(1)吸收塔中的吸收剂X是 ;从副产物FeCl3溶液中获得FeCl3·6H2O的操作是 、加热浓缩、再冷却结晶。
(2)用FeCl3溶液(副产物)腐蚀印刷线路板所得的废液中含FeCl3、FeCl2和CuCl2,用化学方法可以回收废液中铜;合并过滤后的剩余液体可以作为上述工艺流程中的吸收剂X。则在此过程中,先后加入的物质分别是 。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因: 。K2FeO4在水溶液中易发生反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
a.H2O
b.稀KOH溶液、异丙醇
c.NH4Cl溶液、异丙醇
d.Fe(NO3)3溶液、异丙醇
【化学、选修2--化学与技术】TiO2用途非常广泛,工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下: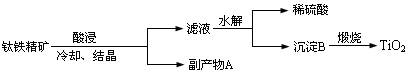
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式 ,酸浸时为了提高浸出率,可以采取的措施有 (任写二种)。
(2)钛铁精矿酸浸后冷却、结晶得到的副产物A为 ,结晶析出A时,为保持较高的酸度不能加水,其原因可能为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和炭粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: , 。
[化学---选修2:化学与技术](15分)银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示: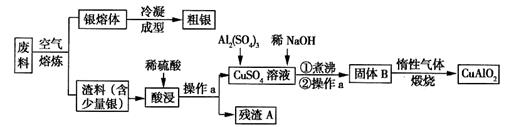
(1)熔炼时被氧化的元素是 ,酸浸时反应的离子方程式为 。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是 。
(2)操作a是 ,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+ Al2O3 + ↑。
+ ↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式 。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为 L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+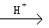 Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的 极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差 g。
【化学──化学与技术】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: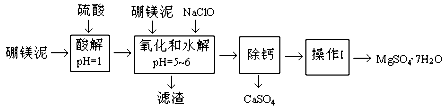
根据题意回答第(1)~(6)题:
(1)实验中需用1mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 。
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为 。
利用和钴氧化物可制备锂离子电池正极材料。
可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为和
溶液。
极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中
向电极迁移(填"A"或"B")。

(2)利用钴渣[含、
等]制备钴氧化物的工艺流程如下:

溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧
生成钴氧化物和
,测得充分煅烧后固体质量为
,
的体积为
(标准状况),则钴氧化物的化学式为。
选做【化学——化学与技术】工业上提炼TiO2的工艺流程如下: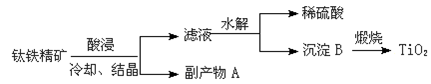
(1)写出硫酸溶解钛铁精矿(FeTiO3)生成TiO2+的离子方程式 。
(2)副产物A的主要成分为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和碳粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: 、 。
[化学——选修2:化学与技术](15分)最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下: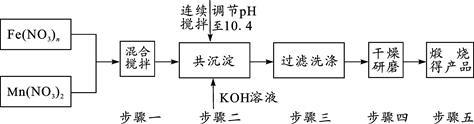
(1)原料Fe(NO3)n中n=____,投入原料Fe(NO3)n和Mn(NO3)2的质量之比应为______。
(2)步骤二中“连续搅拌”的目的是___________________________________________;
步骤三中洗涤干净的标准_____________________________________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为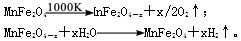
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为_______。
②该热化学循环新氢法的优点有____________________________(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是_____________。
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II.将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV.TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。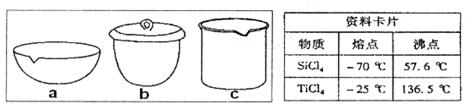
②如实验IV中,应将TiO2.xH2O放在_______(填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2→2O b.O+H2O→2OH(羟基) c.OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
MnO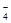 + H2O2+ H+= Mn2++ H2O+
+ H2O2+ H+= Mn2++ H2O+
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中。滴定到达终点的现象是_________________。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”或“偏低”或“不变”)。
④重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。(用分数表示)
下列有关铁、铝的冶炼的说法中,正确的是
| A.冶金工业中,金属铁的冶炼主要采用电解法 |
| B.炼铁过程中铁的氧化物被焦炭还原生成单质铁,电解冶炼铝的过程中,阳极生成铝单质,阴极生成氧气 |
| C.炼铁的主要原料是铁矿石、焦炭、生石灰和空气,电解冶炼铝的原料是氧化铝和冰晶石 |
| D.铁、铝冶炼设备分别是炼铁高炉和铝电解槽 |
选考【化学——选修2:化学与技术】某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中舍有Ni70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化台物的化学性质与铁的类似,但Ni2-的性质较稳定)。
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题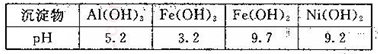
(1)滤渣a的成分是________,用乙醇洗涤废催化剂的目的是________,从废渣中回收乙醇的方法是________。
(2)为提高酸浸速率,可采取的措施有(答两条)________________。
(3)向A中加人 H2O2时反应的离子方程式为__________.试剂x可以是________。
(4)用方程式表示出由沉淀。制取单质镍的方法_________、________。回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为________kg(填计算式)。
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应。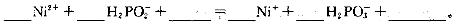
与电镀相比,化掌镀的最大优点是:________________________________。
(12分)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90℃而不在室温下进行的原因是____。
(2)“酸溶”时,Al2O3发生反应的离子方程式为____。
(3)“氧化”时,发生反应的离子方程式为____。
(4)“废渣”成分为________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是____。
用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如下图:
(1)锰泥中加入H2SO4、FeSO4混合溶液,反应的离子方程式是__________。
(2)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/ <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe ;
; ≥0.7时,滤液1中不能检验出有Fe2+。
≥0.7时,滤液1中不能检验出有Fe2+。
①检验Fe2+是否氧化完全的实验操作是__________。
②生产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请从节约药品的角度分析,原因是__________。
若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的方法是__________。
(3)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(4)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg(已知相对分子质量:MnO2 87;MnCO3 115)。
用湿法制磷酸副产品氟硅酸(H2SiF6 )生产无水氟化氢的工艺如下图所示: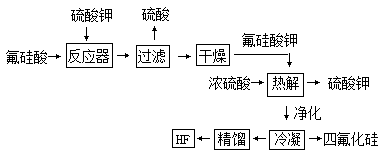
已知:氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于醇。在热水中水解成氟化钾、氟化氢及硅酸。
(1)写出反应器中的化学方程式:
(2)在实验室过滤操作中所用的玻璃仪器有: ;
在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是: ;
(3)该流程中哪些物质可以循环使用: (用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6 ,试写出该反应方程式: ;
(5)为了测定无水氟化氢的纯度,取标况下的气体产物2.24L,测得质量为3.1g,并将气体通入含足量的Ca(OH)2 溶液中,得到5.85gCaF2沉淀,则无水氢氟酸质量分数为: 。(保留2位有效数字)通过计算结果,试解释,为什么标况下2.24L产物的质量远远大于2.0g, 。
【化学—选修2化学与技术】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备硫酸、聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:

请回答下列问题:
(1)过程①中,加快反应速率的方法有 。FeS和O2、H2SO4反应的化学方程式是____________。
(2)过程②中产生的气体可用于氧化产生硫酸,为使SO2尽快、尽多的转化为SO3,可采取的措施是_____(填字母)
A.高温、高压 B.适当温度、催化剂
C.通入过量的氧气 D.低温、低压
产生的尾气会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
A.浓H2SO4 B.蒸馏水 C.NaOH溶液 D.浓硝酸
(3)过程③中,需要加入的物质名称是_______。反应的离子方程式是________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用天平称取样品5.35g;②将样品溶于足量硝酸酸化后,再加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为6.99g。若该聚铁主要成分为[Fe(OH) SO4]n,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
铜工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
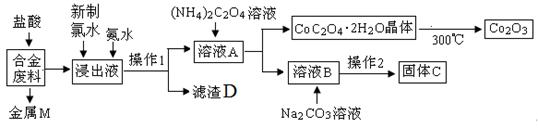
(1)金属M为 ,操作1中需要的主要玻璃仪器是玻璃棒、______、______。
(2)加入新制氯水的的作用是(用离子方程式表示) __________ 。滤渣D的主要成分是 (填化学式)。
(3)充分焙烧的化学方程式为 。如下图所示,焙烧操作中的一处错误是_________。

(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。则操作2中得到固体C的实验操作是:蒸发浓缩、 ,洗涤、干燥。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
试题篮
()