下列说法正确的是
| A.道尔顿、汤姆生、卢瑟福和门捷列夫等科学家对原子结构模型的建立均作出了卓越的贡献 |
| B.神七宇航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| C.淀粉、纤维素互为同分异构体,都属于糖类;硝酸纤维、铜氨纤维都属于酯类 |
| D.生物质能来源于植物及其加工产品所贮存的能量,但不包括城市与工业有机废弃物和农业废弃物等 |
当航天飞机返回地球进入大气层时,由于空气的剧烈磨擦,航天飞机尖端的温度可达1000℃以上。为了防止极高的温度将其烧毁,科学家给航天飞机相应部位设计安装了可靠的保护层。制作保护层的材料可能为
| A.合成塑料 | B.合成纤维 |
| C.镁铝合金 | D.新型陶瓷 |
化学可以帮助人们形成对物质的科学认识,下列说法正确的是
| A.合成纤维和光导纤维都是新型的无机非金属材料 |
| B.维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好 |
| C.水晶、陶瓷、玻璃的主要成分都是硅酸盐 |
| D.蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 |
下列关于化合物的叙述,正确的是
A.纤维素是植物细胞壁的主要成分,它的基本组成单位是葡萄糖
B.动物细胞间质的物质中主要成分是蛋白质,可用胃蛋白酶处理动物组织
C.DNA是生物的主要遗传物质,它的组成元素有C、H、O、N,部分含S、P
D.磷脂是细胞膜的主要成分,也是线粒体、中心体、叶绿体等生物膜的主要成分
下列说法不正确的是
| A.硬铝、碳素钢都是合金材料;合成纤维、光导纤维都是有机高分子化合物 |
| B.油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 |
| C.处理废水时可加入明矾作为混凝剂,以吸附水中的杂质 |
| D.玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要石灰石 |
(1)工业上生产普通玻璃的主要原料是 、 、 (填俗名);
(2)写出通过化合反应制取Fe(OH)3的化学方程式: ;
(3)写出硅酸钠溶液在空气中变质的离子方程式: ;
(4)将CaMg3Si4O12改写为氧化物的形式: ;
(5)在氧化还原反应中,水是反应物,但水作氧化剂的化学方程式: 。
氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下
 (金属离子含量与pH、CuCl产率与混合液中pH的关系图)
(金属离子含量与pH、CuCl产率与混合液中pH的关系图)
请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式);
(2)酸浸时发生反应的离子方程式是 ;
(3)析出CuCl晶体时的最佳pH在 左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
请根据上述流程回答下列问题:
(1)重晶石的化学式为_________,锌钡白可用于调制_______色和浅色油漆。
(2)处理过程(a)的步骤为:①_____________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是 。
(4)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为 。写出设备2中发生反应的离子方程式: _____________________、_____________。
(5)可用 法分离溶液中的钠盐,进行分离前,需要查得的是
。(数据)
(6)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为 (至少写一种)。
(4分) 合成氨工业对国民经济和社会发展具有重要的意义。向2L密闭容器中通入2mol 气体N2和6mol气体H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。
2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。
回答下列问题:
⑴反应2min内,用NH3表示该反应的速率是________________;
⑵反应平衡时,N2的转化率为 ;
⑶如果只升高反应温度,其他反应条件不变,平衡时NH3浓度为 1.1mol/L,则该反应的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20 MPa~50 MPa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
⑸如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
反应速率 (填“增大”、“减小”或“不变”),理由是 ;
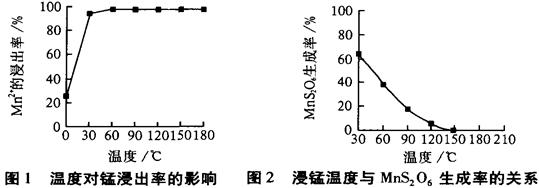
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:
已知生成氢氧化物的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
8.3 |
| 完全沉淀pH |
3.7 |
9.6 |
9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有 。
(2)由图可知,副反应MnSO4+ SO2  MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(3)步骤②中加入MnO2和通入空气的作用 。
(4)③中控制温度为60~70℃,温度不宜太高的原因是 。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是 (写两点)。
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。w ww.k s5u. co m
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用上图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度
控制在50~60℃之间;④反应管出口端出现了CrCl3升华物
时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为 。w ww.k s5u. co m
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 。
③样品中无水三氯化铬的质量分数为 。
用所学化学知识判断下列研究成果或报道可能不属实的是 ( )
| A.某山区发现了一种“柴油树”,它产生的树油可替代柴油使用 |
| B.新型材料碳纳米管的化学性质常温下很稳定 |
| C.美国最新研制出一种燃料电池,其能量转化率很高,可达到100% |
| D.蜘蛛丝(主要成分是蛋白质分子)强度特别大,可以用来制造防弹衣和降落伞绳 |
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为: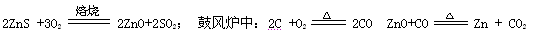
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2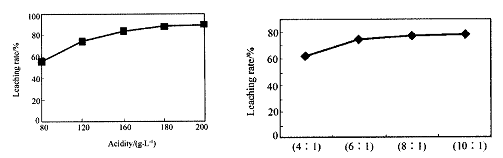
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)  CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a="________ " b=_______
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
试题篮
()